铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
 (4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
【化学———化学与技术】
锶( )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
和 同属于第ⅡA族。
同属于第ⅡA族。
(1)碱性:Sr(OH)2Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 
①Ⅰ中,反应的化学方程式是。
②Ⅱ中,能与盐酸反应溶解的物质有。
③Ⅳ的目的是。
④该工艺流程中NH4HCO3含有的化学键是。
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因。
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是。
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍, 在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4时刻正反应速率随时间的变化曲线: 
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:
①该反应在下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为。(已知: ;
; 。
。 ;
;  。)
。)
(3)已知反应: ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K=(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是。
③该反应的 0(填“<”或“>”);
0(填“<”或“>”);
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是mol,燃烧产物的平均摩尔质量是g/mol。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液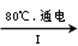 NaClO3溶液
NaClO3溶液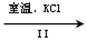 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□。
②Ⅱ中转化的基本反应类型是,该反应过程能析出KClO3晶体而无其它晶体析出的原因是。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。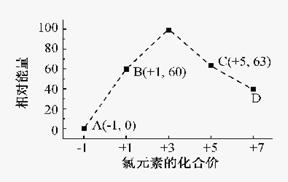
①D是(填离子符号)。
②B→A+C反应的离子方程式为;生成1molC时,KJ的热(填吸收或放出以及具体数值)
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。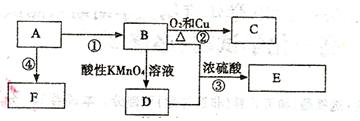
(1)A的结构简式为。
(2)D分子中的官能团是,
(3)写出下列反应的化学方程式
②④