(14分)用50ml 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是 。
(3)实验中改用60 mL 0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是_____________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(12分) 短周期的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素最外电子层上的电子数的和;Y元素原子最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)X元素的名称是___ __;Y元素的名称是______;Z元素的名称是___ ____;
(2)XZ3化合物的化学式是______ _______,Y元素所形成的最高价氧化物的电子式是___ ____;
(3) X、Y的最高价氧化物的水化物的酸性强弱:__________(用化学式表示);
⑷将铜片投放到X的最高价氧化物的水化物的稀溶液中,观察到铜片上有气泡产生,写出该反应的离子方程式:。
(10分)工业合成氨的反应: 是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
⑴相同条件下,1 mol N2和3 mol H2所具有的能量(“大于”、“小于”、“等于”)2 molNH3具有的能量;
⑵如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量(“大于”、“小于”、“等于”)上述数值,其原因是;
⑶实验室模拟工业合成氨时,在容器为2L的密闭容器内,反应经过10min后,生成10 mol NH3,则用N2表示的该反应速率为:;
⑷一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值 d.N2和H2的浓度相等
e. N2、H2和NH3的体积分数相等 f.反应达到最大限度
甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题: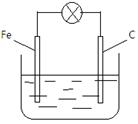
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成(化学式)
,如果他的铁片更换,你认为可以换成(化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极:正极:
(5分)有下列几种物质:①Ne ②NH4Cl ③NaOH ④Cl2 ⑤KNO3⑥CO2 ⑦H202 ⑧Na2O2
属于共价化合物得是(填序号,下同),只存在极性键的是,既存在极性键又存在非极性键的是,既存在极性键又存在离子键的是,既存在离子键又存在非极性键的是。
常温下,有pH值为12的NaOH溶液100 ml,欲将其pH值变为11,采取下列三种措施(忽略混合过程中溶液体积的变化),请回答有关问题:
(1)若加水,应加入ml。
(2)若用pH=10的NaOH溶液,应加入ml。
(3)若用pH=2的盐酸,应加入ml。