(深圳新安中学2008-2009学年第一学期期末)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是:
| A.在冰醋酸中这四种酸都没有完全电离 |
| B.在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42- |
| D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱 |
下列叙述正确的是 ( )
| A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 |
| B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 |
| C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央 |
| D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央 |
最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为()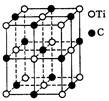
| A.TiC | B. |
C. |
D.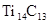 |
“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是()
| A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4; 则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3 |
| B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3; 则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
| D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)也是分子晶体 |
最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是()
| A.该晶体类型是原子晶体 |
| B.该晶体中碳原子和氧原子的个数比为1∶2 |
| C.晶体中碳原子数与C—O化学键数之比为1∶2 |
| D.晶体的空间最小环共有12个原子构成 |
关于晶体的下列说法正确的是()
| A.任何晶体中,若含有阳离子就一定有阴离子 |
| B.原子晶体中只含有共价键 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.离子晶体中只含有离子键,不含有共价键 |