某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时[SO2]=[O2]=6mol/L,平衡时测得[O2]=4.5mol/L,则下列叙述中正确的是( )
| A.SO2的转化率为60% |
| B.SO3的产率为50% |
| C.平衡时总压强与起始压强之比为7∶8 |
| D.平衡时VSO2∶VO2∶VSO3=3∶3∶1 |
实验室用锌与盐酸反应制取氢气,若其他条件不变,下列措施能使该反应速率增大的是
| A.降低温度 | B.用铁代替锌 |
| C.增大盐酸浓度 | D.用锌粒代替锌粉 |
下列物质的性质或用途中,与盐类的水解无关的是
| A.氯化铵溶液可用于除铁锈 | B.明矾可用于净水 |
| C.热的纯碱溶液可用于去除油污 | D.饱和硫酸钠溶液可使蛋白质盐析 |
下列电离方程式中,不正确的是
| A.NaCl = Na++Cl- |
B.HClO ClO- + H+ ClO- + H+ |
| C.NH3·H2O = NH4++OH- |
| D.NaOH = Na++OH- |
下图为铜—锌—稀硫酸构成的原电池示意图,下列说法错误的是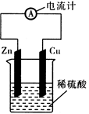
| A.锌片为负极,且锌片逐渐溶解 |
| B.铜片为正极,且铜片上有气泡 |
| C.电子由铜片通过导线流向锌片 |
| D.该装置能将化学能转变为电能 |
下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.XZ线上任意点均有pH=7 |
| C.图中T1<T2 |
| D.M区域内任意点均有c(H+)<c(OH-) |