下述实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将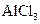 溶液蒸干 溶液蒸干 |
得到Al(OH)3 |
| B |
向沸水中滴加几滴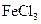 饱和溶液,持续续加热,并不断搅拌 饱和溶液,持续续加热,并不断搅拌 |
制备 胶体 胶体 |
| C |
向某溶液中加入盐酸,将产生的气体通入澄清石灰水 |
检验溶液中是否含有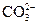 |
| D |
相同温度下,测定浓度分别为0.1mol·L-1的NaHCO3和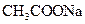 溶液的pH 溶液的pH |
比较碳酸和醋酸电解质能力强弱 |
今有室温下四种溶液,有关叙述正确的是
| ① |
② |
③ |
④ |
|
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.分别加水稀释10倍,四种溶液的pH ①>②>④>③
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb= 9∶11
短周期主族元素W、X、Y、Z位于同一周期,且原子序数依次增大。W、X是金属元素,Y、Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是
| A.W2Y溶液显中性 |
| B.W与Z形成的化合物中不含有离子键 |
| C.1mol元素Z的单质与足量的W的最高价氧化物对应的水化物的溶液反应,转移1mol电子 |
| D.W、X的单质通常是电解其氧化物得到 |
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g)△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g)△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是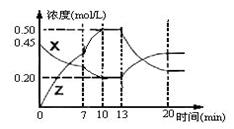
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min) |
| B.化学方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后 |
HF为一元弱酸,在0.1mol·L-1 NaF溶液中,离子浓度关系正确的是
| A.c(Na+)>c(F-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(F-)>c(H+) |
| C.c(Na+) + c(OH-)=c(F-) + c(H+) | D.c(Na+) + c(H+)=c(F-) + c(OH-) |
下列离子方程式错误的是
| A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+ |
| B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑ |
| C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42— |
| D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓ |