向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是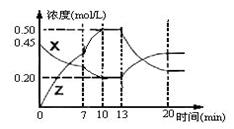
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min) |
| B.化学方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后 |
下列说法正确的是
| A.HClO和NaClO都是弱电解质 |
| B.胶体能产生丁达尔效应,而溶液不能 |
| C.1molH2SO4与1molBa(OH)2反应放出的热量叫做中和热 |
| D.HCl和NaCl溶于水破坏的化学键完全相同 |
下列物质中,既含有离子键又含有非极性键的是
| A.Na2O2 | B.CO2 | C.苯 | D.NH4Cl |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是
| A.反应①中的能量变化如上图所示 |
| B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |
NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA |
| B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 |
| C.6.8克熔融的KHSO4混中含有0.1NA个阳离子 |
| D.标准状况下,11.2L四氯化碳所含分子数为0.5NA |
下列说法或表达正确的是
| A.乙醇、糖类和蛋白质都是人体必需的营养物质 |
B.NH41的电子式: |
| C.石油是混合物,其分馏产品汽油也是混合物 |
| D.陶瓷、水晶、水泥、玻璃都属于硅酸盐 |