硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+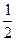 O2(g)
O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2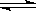 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1)反应5min内,v(O2)=_________mol.L-1.min-1.
(2)化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3)判断该反应达到平衡的标志是_______________;
| A.v消耗(SO2)=v生成(SO3) | B.混合气体的平均相对分子质量不再改变 |
| C.混合气体的密度不再改变 | D.容器中气体的总物质的量不再变化 |
我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图_____________;M元素在元素周期表中的位置为_______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质_____________();
X与W按原子个数比2:1形成的化合物 _____________().
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为_____________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性__________________________(用氢化物分子式表示)
Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式,
________________________,________________________,______________________;
(6)写出一个化学反应方程式,证明下列结论:
非金属性M比W强:__________________________________________________________;
非金属性Q比Z强:______________________________________________________________。
(6分)下列物质中:
(1)互为同分异构体的有(2)互为同素异形体的有
(3)属于同位素的有(填序号)
①液氯② ③白磷④氯气⑤
③白磷④氯气⑤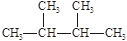
⑥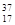 Cl⑦
Cl⑦ Cl⑧红磷
Cl⑧红磷
下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题: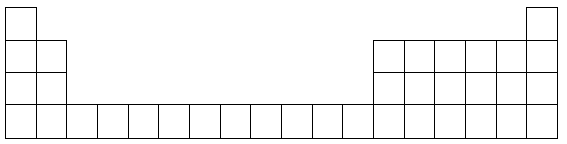
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有(填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有_______种,属于d区的元素有_______种。第二周期元素中除Ne外电负性由高到低的三种元素依次是_______,电离能由高到低的三种元素依次是_______。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:_____________________________