某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同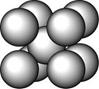

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , 经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为 pm,试解释该晶体原子化热很高的原因 。
(已知 ,7.407≈
,7.407≈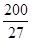 ,1pm=10
,1pm=10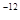 m)
m)
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
(1)CO、CH4均为常见的可燃性气体。已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是。
(2)已知:P4(g)+6Cl2(g)=4PCl3(g)△H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g)△H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。则Cl-Cl键的键能为kJ∙mol—1
(3)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H
为(用△H1、△H2、△H3表示)
(4)已知一定温度和压强下,合成氨反应:
N2(g)+3H2(g) 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是(填“吸收”或“放出”) kJ热量。
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是(填“吸收”或“放出”) kJ热量。
已知A(g)+B(s) C(g)+D(g)△H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
C(g)+D(g)△H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
(1)如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率(填“变大”、“变小”或“不变”);
(2)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(3)100℃时,该反应达到平衡后,D的浓度为0.02mol/L,改变反应温度为T,c(A)以0.001mol/(L·s)的平均速率降低,经10s又达到平衡。
①T100℃(填“大于”或“小于”),判断理由是;
②温度T时,反应达到平衡后,将反应容器的体积减少一半。平衡向(填“正反应”或“逆反应”)方向移动。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。(填序号)
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)下图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:
________________________________________________________________________。
(10分)小王同学准备用CuSO4·5H2O配制500 mL 1 mol/L的溶液。
(1)小王同学选用的容量瓶容积的规格是mL;
(2)玻璃棒在该实验中有重要的用途,分别是和 ;
(3)小王同学通过计算,用托盘天平称取g CuSO4·5H2O。
(4)配制好的溶液呈色。小王同学还想通过实验证实溶质中含有SO42-,请你帮他想想办法,选择适当的试剂,并写出其相应的实验步骤、现象以及离子方程式。
| 溶质 |
实验步骤 |
实验现象 |
离子方程式 |
| SO42- |
(5)物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将;
②定容时,若眼睛俯视,则所配制的溶液浓度将。