在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是 。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重 g,阴极上的电极反应式是 。
(4分)(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为________。
(10分)有下列各组物质:
| A.O2和O3; | B.23592U和23892U; |
C.CH3CH2CH2CH3和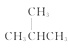 ; ; |
|
D.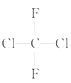 和 和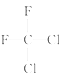 ; (E)甲烷和新戊烷 ; (E)甲烷和新戊烷 |
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体;
(5)__________组两物质互为同一物质。
在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为: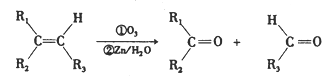
已知:
①合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
⑴写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中的一组)
A______________,C_____________,E________________.
⑵写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式:
_______________________________________________________________________
已知醛在一定条件下可以发生如下转化: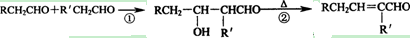
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题:
(1)A、B的结构简式为:AB。
(2)G、D反应生成H的化学方程式是:。
(3)一定条件下,能够与1molF发生反应的H2的最大用量是mol。
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为:(只要求写一种)。
分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,丙烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1mol H2,若甲还能与NaHCO3溶液反应,则甲的结构简式为;若甲还能发生银镜反应,则甲的结构简式为。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为:。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,则丙结构简式为。