(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3—也被称为类卤离子。用酸与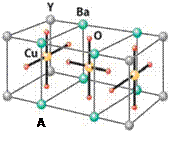
叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼
金属,如溶解铜生成CuCl2—。铜和铂的化合物在超导和医药上有重要应用,
Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试
回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,N3—的空间构型是_____,与N3—互为等电子体的分子的化学式为 (写1种)。NH2—的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2—中的键型为 ,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺 。已知:反应(Ⅰ)的化学方程式为:FeSO4•7H2O+2NH4HCO3= FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KC1=K2SO4+ 2NH4Cl
工艺流程如下: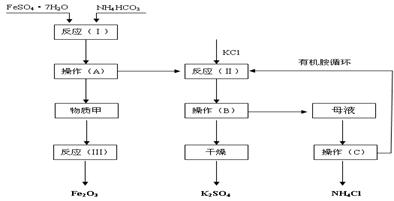
试回答下列问题:
(1)该工艺中的副产品是 。(填化学式)
(2)操作C的名称为 。
(3)原料绿矾、碳酸氢铵的最佳投料比是 (质量比)时,FeSO4的转化率大于95%。
(4)物质甲是 (填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700~800℃,煅烧时间为1~1.5 h时可获得符合国标一级品要求的氧化铁红,其化学方程式是__________。
在一定条件下xA+yB zC达到平衡时,请填写:
zC达到平衡时,请填写:
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___________________。
(2)已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是_________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是___________反应(填“放热”或“吸热”)。
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则 。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为___________ 。
又已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如下图一所示。
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间
是 。
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应
的平衡常数为 。
③氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对于反应:N2O4(g) 2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
分数随压强变化曲线如下图二所示。
下列说法正确的是 。
a.A、C两点的反应速率:A﹤C
b.A、C两点的气体颜色:A浅,C深
c.B、C两点的气体平均相对分子质量:B﹤C
d.A、C两点的化学平衡常数:A﹥C
e.由状态B到状态A,可以用加热的方法
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g) 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
(1)该电池工作时,b口通入的物质为____________,c口通入的物质为__________。
(2)该电池负极的电极反应式为_________________。
(3)工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有__________NA个电子转移。
(4)若将a口排放出的1.12L气体,通入到5L0.015mol·L-1NaOH溶液中完全反应。反应后的溶液中离子浓度由大到小的顺序为 。