甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=" +" 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H2=-192.9 kJ·mol -1
下列说法正确的是
| A.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成 CO2和H2O(l)放出的热量应大于192.9 kJ |
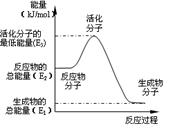
| B.反应②中的能量变化如右图所示,则△H2= E1- E3 |
| C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 |
| D.CH3OH的燃烧热△H=-192.9 kJ·mol -1 |
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
| A.9:1 | B.1:11 | C.1:9 | D.11:1 |
常温时,将pH为5的HCl溶液与pH为2的HCl溶液等体积混合后,溶液的氢氧根离子浓度最接近于( )
| A.2×10-12mol/L | B.1/2(10-9+10-12)mol/L |
| C.(10-9+10-12)mol/L | D.1/2(10-5+10-2) |
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是()
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| D.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是()
| A.④>③>①=⑤>② | B.①=②>③>④>⑤ |
| C.②>①>③>④>⑤ | D.④>③>①>⑤>② |
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是()
| A.X=Y=Z | B.X>Y=Z | C.X<Y=Z | D.X=Y<Z |