化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______ 。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______ ,电池工作时,固体电解质里的O2-向 _______ 极移动。 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 _______ ,第5~6min之间,改变的条件是 _______ 。T℃时该化 学反应的平衡常数是 _______ 。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______ 。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______ 0(填“>”、“=”、“<”).
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。(已知—OH,—COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
 |
(1)推断C、F的结构简式。C: ;F: 。
(2)B中所含的官能团有 ;反应③的反应类型是 。
(3)反应①的化学方程式为 。
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性。一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是
。
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)
____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在__________;目的是_______________;当试管A内的主要反应完成后温度计水银球的位置应在_____________,目的是_____________________________;
(3)烧杯B的作用是_________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________。
某化学课外活动小组,从化学手册上查得硫酸铜在500℃以上按下式分解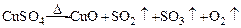 ,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图所示:
,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图所示: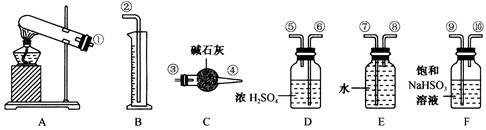
实验测得数据及有关结果如下:
①准确称取6.0g无水CuSO4;②干燥管总质量在实验结束时增加了2.4g;③测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质)。
试回答下列问题:
(1)按装置从左至右的方向,各仪器接口连接顺序为____________________(填序号)。
(2)装置F的作用是_______________________________________________________。
(3)装置D的作用是_______________________________________________________。
(4)确定装置E的进、出口的原则是_____________________________。
(5)首先应计算的是物质__________的体积;通过计算,推断出该条件下反应的化学方程式:_______________________________________________________。
(6)该实验设计中,可能给测定带来误差最大的装置是(填代号)________________。
下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是:。
(3)G与H反应的离子方程式是,
E转变为H和I的离子方程式是。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成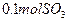 ,可放出
,可放出 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。