(A).【物质结构与性质】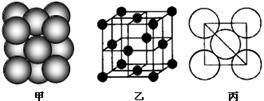
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| |
|
|
|||||||||||||||
| |
|
|
|
|
A |
|
|
|
|||||||||
| |
|
B |
|
|
C |
|
|
||||||||||
| |
|
|
|
|
|
D |
E |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
| 元 素 |
D |
E |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
(B).【实验化学】
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图,。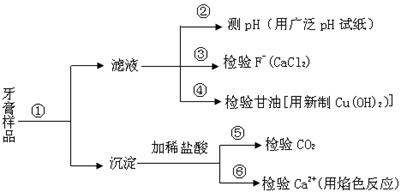
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)写出④中发生反应的化学方程
式: 。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是 、
(任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为,15.6g Na2O2在该反应中转移电子的物质的量为mol。
(2)反应结束时生成的气体在标准状况下为L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下
放出气体V L,则V的取值范围是(用含a的代数式表示,结果可不化简)。
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液 d.饱和Na2CO3溶液
e.新制CaO f.饱和NaCl溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 F.盐析 |
| 混合物 |
需加入的试剂 |
分离方法 |
| 苯(苯酚) |
||
| 高级脂肪酸钠(甘油) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)C的元素符号为 D2+的电子排布式为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
该化合物的化学式为_________;D的配位数为_______;该晶体的密度为_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO②TiCl4+2Mg
TiCl4+2CO②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。