有四种钠的化合物W、X、Y、Z,根据以下反应式判断W、X、Y、Z的化学式。
(1) W X+H2O+CO2↑
X+H2O+CO2↑
(2) (2)Z+CO2→X+O2
(3) (3)Z+H2O→Y+O2↑
(4) (4)X+Ca(OH)2→Y+CaCO3↓
(5) W________,X________,Y________,Z________。
第47届联合国大会将每年的3月22日定为“世界水日”。我国是一个淡水资源平均水平远低于世界平均水平的缺水国家,海水淡化是解决我国淡水缺乏的一种好方法,海水淡化技术成为我国“十五”期间科技攻关的一个项目,海水淡化也被誉为21世纪的朝阳产业。
(1)有一种真空蒸发式海水淡化装置,该装置利用柴油机缸套废热水加热海水,使其蒸发汽化,蒸发温度为40 ℃左右。产出的蒸汽冷凝成淡水,淡水汇入集水槽,由水泵抽出,供船上使用。该装置的原理为__________________________________,与电渗析法原理________(填“相同”或“不相同”)。
(2)海水的沸点大约为105 ℃,为什么在此条件下蒸发温度仅为40 ℃左右?
________________________________________________________________________。
(3)该淡化过程中体现了哪些资源的合理利用?
________________________________________________________________________。
(4)请你试着评价一下真空蒸发式海水淡化装置的优缺点:
________________________________________________________________________。
海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩。如图,左侧为海水,右侧为经过一段时间后由左侧经高分子膜渗透得到的淡水,分析高分子膜应具有的性质是________________________________。
某自来水中含有Ca2+、Mg2+、Na+、K+、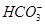 、
、 、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
| 物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
| 溶解度 g/100 g H2O |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:
________________________________________________________________________
________________________________________________________________________。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是____________。(填序号)
A.NaOH B.NaHCO3
C.Na2CO3 D.NaCl
CaSO4能转化为物质Y的原因是(用文字叙述)_______________________________________
________________________________________________________________________。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)_________________ _______________________________________________________。
(4)若所用自来水的硬度为33.6度(计算硬度是将Ca2+、Mg2+都看成Ca2+,并将其折算成相当于CaO的质量,通常1 L水中含有10 mg CaO称为1度)。1 t这样的水中相当于含CaO的物质的量为__________(水的密度为1 g/cm3)。
(5)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自来水样10 mL至锥形瓶中进行滴定,达到滴定终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________。
某城市用水中含c(Ca2+)为1.0×10-3 mol·L-1,c(Mg2+)为5.0×10-4 mol·L-1,c(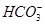 为8.0×10-4 mol·L-1。如用药剂软化该水1000 L,应加入Ca(OH)2________ g,Na2CO3________ g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为_____________________________________。
为8.0×10-4 mol·L-1。如用药剂软化该水1000 L,应加入Ca(OH)2________ g,Na2CO3________ g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为_____________________________________。
天然水里一般含有Ca2+、Mg2+等多种离子。人们把含有较多量Ca2+、Mg2+的水叫做硬水,含有较少量或不含Ca2+、Mg2+的水叫做软水;降低水中Ca2+、Mg2+含量的过程叫做硬水软化。如果硬度太高(含Ca2+、Mg2+的浓度太大)会给生产、生活带来很多不利,因此硬水的软化是水处理的重要方面之一。
离子交换法常用于工业锅炉用水的软化。离子交换剂多种多样,磺化煤(NaR)就是一种阳离子交换剂。
(1)写出用磺化煤软化含Ca2+、Mg2+浓度较高的硬水的化学方程式____________________。
(2)用药剂软化法软化过的水总是含有一定浓度的Ca2+、Mg2+,其原因是_______________。
(3)参考烧水后的锅或壶中结有水垢的现象分析说明,如果用硬度太高的水作锅炉用水,主要的不利因素是________________________________________________________________。