A、B、C、D都是短周期元素,原子半径D>C>A>B。其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内质子
 数之和,C原子最外层电子数是D原子最外层电子数的4倍。
数之和,C原子最外层电子数是D原子最外层电子数的4倍。 19
19
(1)写出C元素在周期表的位置:第 周期 族
(2)画出元素D的离子结构示意图: 。B存在同素异形现象,其中常用作消毒剂的是 。(填化学式)
(3)这四种元素中的非金属气态氢化物的稳定性由大到小的顺序: (填化学式)
(4)A与B形成的三原子分子的结构式: ,B与D形成的原子个数比为1:1的化合物的电子式: 。
(5)C的氧化物和D的最高价氧化物对应水化物反应的离子方程式为: 。
一定条件下,在体积为3 L的密闭容器中有反应:
CO(g)+2H2(g)  CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题:
CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题: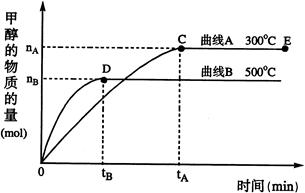
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,H2的平均反应速率v(H2)=(用nB、tB表示);
(3)下列描述中能说明上述反应已达平衡的是;
a.v(CO)=2v(H2)
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)开始向密闭容器中充入0.10 molCO和0.20 molH2,一段时间后达到平衡,测得容器中CH3OH物质的量为0.08 mol;若再通入0.10 molCO和0.20 molH2,则平衡移动 (填“正向”、“逆向”或“不”);若平衡移动,再次达到平衡后,mol<n(CH3OH)<mol。
日常生活中的塑料包括很多种,其中PET(聚对苯二甲酸乙二醇酯)塑料被广泛用于生产包装瓶、电器元件、汽车配件等;PS塑料被广泛应用于光学工业中,PET塑料、PS塑料可按下图所示合成。
(1)C能与含氧酸发生酯化反应,则C的分子式为,其所含的官能团的名称为。
(2)X、Y互为同分异构体,分子式为C8H10,则X的结构简式为,
其核磁共振氢谱有种峰。
(3)D分子中含有一个甲基,则D→E的化学方程式为,
E与CH2=CH—CH=CH2在一定条件下1︰1发生反应生成除苯环外无支链的高聚物的化学方程式为。
(4)Z是B的同分异构体,其具有如下性质:①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应放出CO2;③苯环上的一氯代物只有三种;④苯环上只有2个取代基相邻。则Z的结构最多有种,写出其中一种的结构简式。
下表是A、B、X、Y、Z五种有机物的有关信息:
| A |
 B B |
X |
Y |
Z |
|||
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:
|
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与Z反应生成相对分子质量为100的酯。 |
①相对分子质量比X少2; ②能由X氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做 ,写出在一定条件下,A生成高分子化合物的化学反应方程式__ _____。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有下列性质中的哪些? (填号):
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(4)X与Z反应能生成相对分子质量为100的酯,该反应类型为 ;其化学反应方程式为: 。
(5) 写出由X氧化生成Y的化学反应方程式: 。
为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验: 回答下列问题:
回答下列问题:
(1)准确量取11.40 mL液体所用仪器是________;
(2)加入过量硝酸的作用是___________________________________________;
(3)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是________;
(4)已知此卤代烃液体的密度是1.65 g/mL,其蒸气对甲烷的相对密度是11.75,则此卤代烃每个分子中卤原子的数目为_______个;此卤代烃的结构简式为:_。
下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素。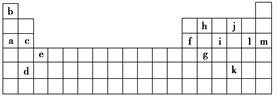
(1)上述第三周期元素中第一电离能(I1)最大的是________(用字母表示,下同),c和f的I1大小关系是________大于________。
(2)上述元素中,原子中未成对电子数最多的是________,写出该元素的电子排布式:________________。
(3)根据下表所提供的电离能数据,回答下列问题。
| 锂 |
X |
Y |
|
| I1 |
519 |
502 |
580 |
| I2 |
7296 |
4570 |
1820 |
| I3 |
11799 |
6920 |
2750 |
| I4 |
9550 |
11600 |
①表中X可能为以上13种元素中的________元素。用元素符号表示X和j形成的化合物的化学式________。
②Y是周期表中的________族的元素。