工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250°C |
300°C |
350°C |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
(1)c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
(2)a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
(3)p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
(4)a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
铝热反应常用于冶炼高熔点的金属,可简单认为是铝与某些金属氧化物在高温条件下发生的反应。某学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究。
查阅数据得到Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下表所示:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1565[ |
| 沸点/℃ |
2467 |
2980 |
2750 |
┄ |
试回答下列问题:
(1)在铝热反应中金属铝表现出性(填“氧化”或“还原”)。请判断下列金属中那一个不能由铝热反应制取。(填序号)
①Fe;②Cr(铬);③V(钒);④Ca;⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属。如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为,可观察到的实验现象是。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3。则
①物质甲是(填化学式)。
②该同学的实验方案是否合理?(填“合理”或“不合理”)。
理由:
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸; C和D是两种常见的强酸。请回答下列问题: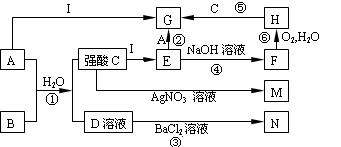
(1)写出物质B和M的化学式:B.,M ;
(2)写出反应②的离子方程式:;
(3)写出反应⑥的化学方程式:;
(4)在反应①②③④⑤⑥中,属于氧化还原反应的有: 。(填编号)
(1)下列物质中水溶液能导电但属于非电解质的有(填序号)①乙醇 ②氨气 ③氯气 ④氯化钠 ⑤硫酸 ⑥干冰 ⑦BaSO4 ⑧醋酸 ⑨氢氧化钠 ⑩CaO
(2)某实验需要使用240ml 0.4mol/L CuSO4溶液,用胆矾配制该浓度溶液需要使用的仪器有托盘天平、烧杯、玻璃棒、、;需要称量克胆矾;若所称胆矾失去部分结晶水,则配制出的溶液浓度。(填偏高、偏低或无影响)
(3)汉紫是中国古代兵马俑和古代壁画中的一种颜料,其化学式是BaCuSi2O6,请用氧化物的形式表示其组成:。
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++ O2+ 4H+=4Fe3++ 2H2O,则另一反应的离子方程式为;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g)△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式。
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
(1)加入新制氯水后溶液中发生的离子反应方程式是_________________________、
Fe3+ +SCN- [Fe(SCN) ]2+。
[Fe(SCN) ]2+。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水B.稀盐酸C.稀硫酸D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?