A.《物质结构与性质》模块
二茂铁【(C5H5)2 Fe】是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)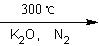 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: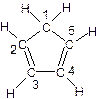 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号), 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
B.《实验化学》模块
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 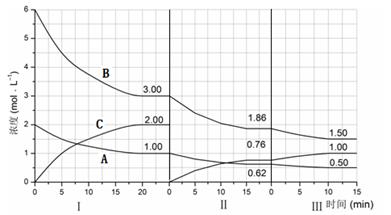
回答问题:
(1)反应的化学方程式中,a:b:c为;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是,其值是;
(3)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2T3(填“<”、“>或“=”),判断的理由是;
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中B物质的浓度随时间变化的趋势(注:只须画出B的浓度随时间变化曲线)。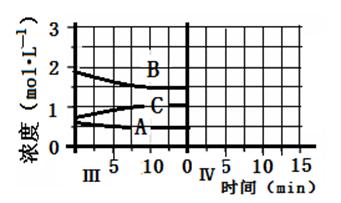
一定条件下,反应室(容积恒定为2L)中有反应:A(g) +2B(g) C(g)
C(g)
(1)能说明上述反应达到平衡状态的是(选填字母)。
A.反应中A与B的物质的量浓度之比为1︰2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2υ正(A)= υ逆(B)
(2)该反应平衡常数K的表达式:K= 。
(3)1molA(g)与2molB(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如下图所示,则: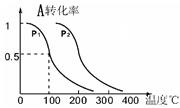
①P1P2 , 正反应的△H0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是(选填编号)。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(4)100℃时将1mol A和2molB通入反应室,保持温度不变,10min末C(g) 的浓度为0.05mol/L ,则10min末B转化率= ,此时υ正υ逆
(填“<”、“>”或“=”)。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: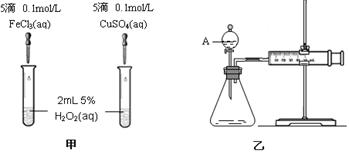
(1)定性分析:如图甲可通过观察,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为,检查该装置气密性的方法是,
实验中需要测量的数据是。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。实验过程中速率变化的趋势是,可能原因是。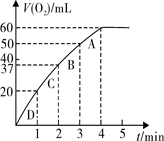
计算H2O2的初始物质的量浓度为mol/L(请保留两位有效数字)。
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g)△H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l)△H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为(填字母)。
| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |
(3)实验室可以利用下图装置进行中和热测定。回答下列问题:
①请指出该装置还缺少的仪器是;
②两烧杯间填满碎泡沫塑料的作用是;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是(由大到小)。
某金属氯化物MCl227g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为,金属M的相对原子质量为。