目前用乙烯制乙醛的过程分三步进行:
①CH2==CH2+PdCl2+H2O CH3CHO+2HCl+Pd
CH3CHO+2HCl+Pd
②Pd+2CuCl2 PdCl2+2CuCl
PdCl2+2CuCl
③2CuCl+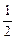 O2+2HCl
O2+2HCl 2CuCl2+H2O
2CuCl2+H2O
下列叙述正确的是
| A.CH2==CH2是还原剂,PdCl2是氧化剂 |
| B.CuCl是还原剂,O2是氧化剂 |
| C.乙烯是还原剂,O2是氧化剂 |
| D.PdCl2和CuCl2都是催化剂 |
关于盐类水解的实质,下列叙述正确的是( )
| A.盐的电离平衡被破坏 |
| B.水的电离平衡被破坏 |
| C.没有中和反应发生 |
| D.溶液的pH一定变大 |
在一定条件下,Na2CO3溶液存在水解平衡:C+H2O HC+OH-。下列说法正确的是( )
HC+OH-。下列说法正确的是( )
| A.稀释溶液,水解平衡常数增大 |
| B.通入CO2,平衡向正反应方向移动 |
| C.升高温度,减小 |
| D.加入NaOH固体,溶液pH减小 |
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )
| A.酸的强弱:HCN>HClO |
| B.pH:HClO>HCN |
| C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D.酸根离子浓度:c(CN-)<c(ClO-) |
25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类不同 |
| C.c(OH-)前者小于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
| A.丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的 |
| B.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| C.乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的 |
| D.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |