工业上为了处理含有Cr2O72-的酸性工业废水,采用下列的处理方法:是绿矾(FeSO4·7H2O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。其主要的化学方程式如下:
H2Cr2O7+6FeSO4+6 H2SO4=Cr2(SO4)3+3Fe 2(SO4)3+7H2O
现用上述方法处理1×104L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH)3外,还有 . (用化学式表示)。
⑵需用绿矾的质量 。
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
(1)该温度下的该反应的平衡常数=__________________(用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
化学平衡将向________方向移动,NO2的转化率将____________;
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同)
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 molH—O键
c.υ正(CO) =υ逆(H2O)
d.c(CO)=c(H2)
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.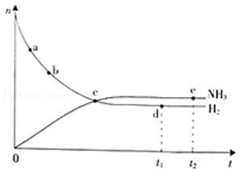
下列叙述正确的是(填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是(填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为(用含α甲的代数式表示,化简为最简式),此时α甲α乙(填“>”、“<”“=”).
一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图: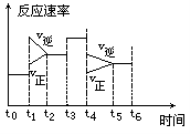
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化? 、、
(3)下列各时间段时,氨的百分含量最高的是______.
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是。
(2)如图是198K时N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为:。
(3)写出以下物质的电离方程式:
NaHCO3;
CH3COONH4;
H2CO3