实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50℃—60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,然后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是_______________。
(2)步骤③中,为了使反应在50℃—60℃下进行,常用的方法是_____________。
(3)步骤④中洗涤,分离粗硝是苯应使用的仪器是__________________________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是_______________________。
(5)纯硝基苯是无色,密度比水__________________(填“小”或“大”),具有________
气味的油状液体。
(7分)如下图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。根据图分析回答: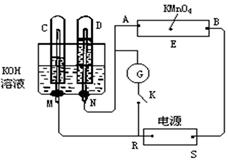
(1)R为____极,S为_____极。
(2)A附近溶液的现象是__________,B附近发生的电极反应式为:
。
(3)滤纸上的紫色点向哪方移动____(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,有关的电极反应式为(−)(+)。
(8分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)c(CN−)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是。
(4分)在温度t℃下,某NaOH的稀溶液中c(H+)=10−a mol/L,c(OH−)=10−b mol/L,已知a+b=12,该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示,假设溶液混合前后的体积变化忽略不计,则c为_____________ 。
| 序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
20.00 |
0.00 |
8 |
| ② |
20.00 |
20.00 |
6 |
(4分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
| △H/(KJ/mol) |
-283.0 |
-285.8 |
-726.5 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列热化学方程式CO(g)+ 2H2(g)= CH3OH(l)△H=
(4分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)  Cu2+(aq)+2OH−(aq),常温下其Ksp=c(Cu2+)· c2(OH−)=2×10−20
Cu2+(aq)+2OH−(aq),常温下其Ksp=c(Cu2+)· c2(OH−)=2×10−20
(1)某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2 mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一可视为Cu2+沉淀较为完全),则应向溶液里加入氢氧化钠溶液使溶液pH为 。