实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同
学设计下列实验以确定上述混合气体中含有乙烯和SO2。
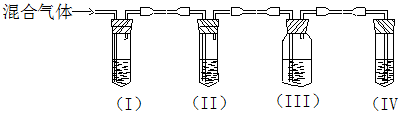 |
(1)I、II、III、IV装置可盛放的试剂是:I II III IV(请将下列有关试剂的序号填入空格内)
| A.品红 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是 ;
(1)使用装置II的目的是 ;
(2)使用装置III的目的是 ;
(3)确定含有乙烯的现象是 。
A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______(填元素符号),其基态原子的电子排布式为 _______。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______(填“大”或“小”)。
 |
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 _______(填物质字母代号)。
(3)晶格能的大小:MgO _______NaCl,键能的大小:HBr _______HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: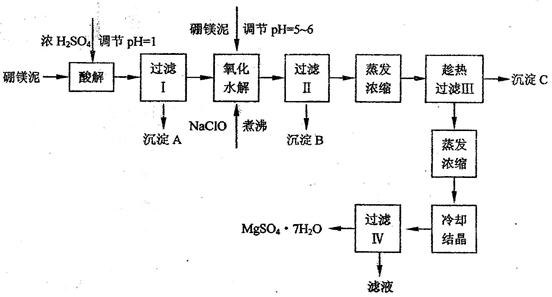
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______。加热煮沸的主要目的是_ _______。
(2)沉淀B中除MnO2、SiO2外还含有 _______(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______;
(4)沉淀C的化学式是 _______。过滤II需趁热过滤的理由是 _______
80年代中期美国学者Modell首次提出超临界水氧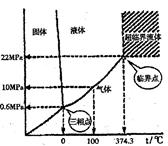
化技术(SCWO)。超临界流体(SCF)是指流体的温度和压
力处于它的临界温度(Tc)和临界压力(Pc)以上时的一种
特殊状态的流体,它具有许多独特的性质,如无机盐在超
临界水(SCW)中的溶解度很低。水的状态与压强、温度的
关系如右图。
(1)在380℃.20 MPa时,水的状态是 _______,若要使
之成为超临界水,必须采取的措施是 _______。
(2)以超临界水为介质,用氧气等氧化剂可将有机废物氧化成二氧化碳、氮气、水等无毒小分子。在超临界水中,偏二甲胼[(CH3)2NNH2]能迅速被H2O2氧化,写出该反应的化学方程式: _______
(3)SCWO基本工艺流程如下图所示: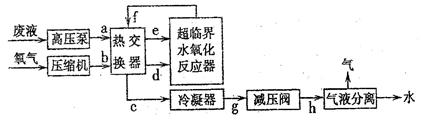
利用以上工艺流程处理某些含可溶性无机盐(只含钠盐、钾盐)的有机废水时,常常会出现管道堵塞现象,发生这种现象的原因是 _______。若检测到管道c中的流体的温度为287℃,管道e、d中的流体的温度为227℃,则上述a~h管道中易发生堵塞的管道为 _______(填字母)。
实验室用右图所示的装置制取溴乙烷。在试管I中依次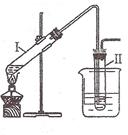
加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠
粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _______。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _______(任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
| 实验步骤 |
实验操作 |
预期现象和结论 |
| 1 |
_______ |
_______ |
| 2 |
_______ |
_______ |
| 3 |
_______ |
_______ |
| 4 |
_______ |
_______ |
(4)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯。在答题卡对应的方框中画出实验装置图,并注明所用试剂的名称。
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______,电池工作时,固体电解质里的O2-向 _______极移动。 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 _______,第5~6min之间,改变的条件是 _______。T℃时该化 学反应的平衡常数是 _______。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______0(填“>”、“=”、“<”).
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为 _______。电解粗铜制取精铜,电解时.阳极材料是 _______,电解液中必须含有的阳离子是 _______。
(2)在100 mL 18 mol/L浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4< __mol。
(3)电子工业曾用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重薪得到FeCl3溶液,设计如下实验流程。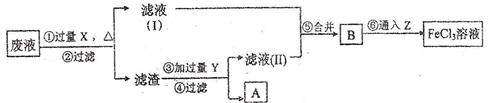
上述流程中,所加试剂的化学式为:X _______,Y _______Z _______;第⑥步反应的离子方程式为 _______。