某化学课外小组所做实验的示意图如下图
 |
 图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1)A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(5)当F中为紫色石蕊试液时,见到的现象是 主要
反应方程式
为 、 。
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
试回答下列问题。
(1)该实验中漏斗的作用是什么?。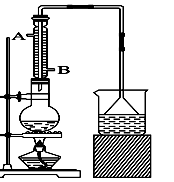
(2)反应装置中的烧瓶应选择下列哪种规格最合适()
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是()
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是用洗涤后分液。
A、浓NaOH溶液 B、Na2SO3溶液 C、CCl4 D、水
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:
。
(每空2分,共18分)
(一)实验室用下图装置制取少量溴苯,试填写下列空白。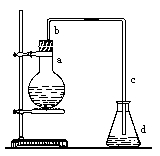
(1)在烧瓶a中装的试剂是。
(2)长直导管b的作用:。
(3)请你分析导管c的下口可否浸没于液面中?(填“可”或 “否”)。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液,有关反应的离子方程式:。
(二)某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
乙醇的催化氧化反应是________反应(填“放热”或“吸热”),
该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是
(填戊装置中导管代号):乙接、_______接丙;
若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。
下图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): _____________ , ___________
(2)试管C中苯的作用是_____ 。反应开始后,观察D和E两试管,看到的现象为_____ 。
(3)在上述整套装置中,具有防倒吸作用的仪器有_____ (填字母)。
Ⅰ.某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有;
②使用容量瓶前必须进行的一步操作是;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。
①写出实验室制氨气的化学方程式:;
②写出B中盛放的是碱石灰其作用是;
③氨气极易溶于水,在氨水中滴加酚酞现象是;
④检验氨气的方法是。
Ⅱ.在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: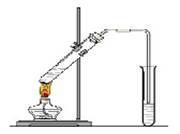
(1)写出制取乙酸乙酯的化学反应方程式。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化