某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失)。若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)该实验主要是探究___________ 、 和 对反应速率的影响。
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。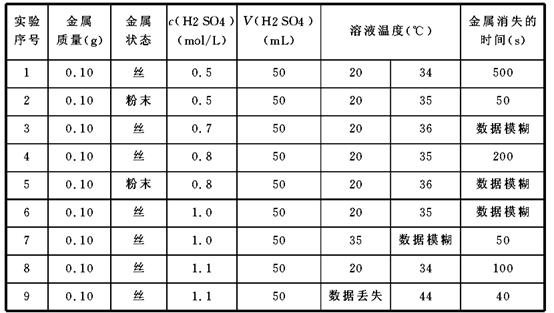
氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是:
_______________________________________________________________________。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4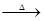 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:
①在该实验中,甲部分的装置是__________(填字母)。
如何检查该装置的气密性?______________________________________________。
②乙装置中FeCl2溶液与Cl2:反应的离子方程式是_______________。
③丙装置中通人少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸.则丙中发生反应的化学方程式是____________。
④该实验存在明显的缺陷.改进的方法是________________________________________________。
(12分)实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液b.蒸馏水
c.浓硫酸d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
(15分)硫代硫酸钠是一种重要的化工产品。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(II)
S(s)+Na2SO3(aq) Na2S2O3(aq)(III)
Na2S2O3(aq)(III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水b.饱和Na2SO3溶液
c.饱和NaHSO3溶液d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质)。某兴趣小组为测定该产品纯度,准确称取4.96g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L¯1碘的标准溶液滴定。反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如下图,则产品的纯度为_________。
经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)_______。
[M(Na2S2O3•5H2O)=248g/mol]
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因:、。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明;②实验III的目的是。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制①mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是②。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
(15分)某兴趣小组利用下列实验装置进行探究实验。
根据要求回答下列问题:
(1)装置中长颈漏斗的作用有导气、。
(2)利用装置C可以证明S02具有漂白性,C中盛放的溶液是;若要证明其
漂白作用是可逆的,还需要的操作是。
(3)通过观察D中现象,即可证明S02具有氧化,D中盛放的溶液可以是。
a.NaCl溶液b.酸性KMn04c.FeCl3d.Na2S溶液
(4)研究小组发现B中有白色沉淀生成,若往B中加入过量稀盐酸,沉淀不溶解。沉淀物的化学式是。
(5)为进一步验证B中产生沉淀的原因,研究小组进行如下两次实验:
实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊。
实验ii:用下图F装置代替上述实验中的A装置(其他装置不变),连接后往装置F中通入气体X一段时间,再加入70%H2S04溶液,结果B中没有出现浑浊。
①“实验i”中煮沸BaCl2溶液的目的是;
②气体X不可以是(填序号)。
a.C02b.03c.N2d.N02
③B中形成沉淀的原因是(用化学方程式表示):。