(12分)实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白: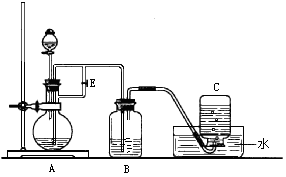
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的化学方程式为________________________________。
(2)实验开始时应先将活塞E________(填“打开”或“关闭”),目的是________,在C中收到的气体主要为________________。
(3)简述生成Fe(OH)2的操作过程______________________________________
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。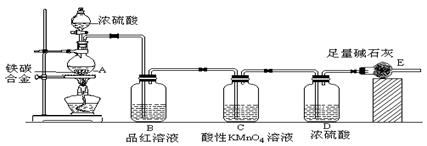
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② ___________________ 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 ______________________ 。
⑶B中的现象是: _______________________________________ ;
C的作用是: ___________________ _______________________ 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 _____________ (写表达式)。
(5)反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ: 。
|
验证Ⅲ的实验方法是 。
有一份铵盐混合物,取其质量为10.00g时,含有xmol的(NH4)2SO4和ymol的NH4HSO4 。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
测定结果如下;
铵盐混合物质量为10.00g和20.00g时,浓硫酸增加的质量相同;
铵盐混合物质量为30.00g时,浓硫酸增加的质量为0.68g;
铵盐混合物质量为40.00g时,浓硫酸的质量不变。
(1)A气体的化学式为______________
(2)10.00g铵盐混合物中含有NH4+的物质的量为_____mol(用含x,y的关系式表示),10.00g铵盐混合物溶于水后可电离出H+的物质的量为___mol(用含x,y的关系式表示)。
(3)在含有2 mol NH4+与1 mol H+的溶液中加入2 molOH—,加热充分反应,可产生气体A__________ mol
(4)计算:50.00mL的NaOH溶液的浓度为__________mol/L,该铵盐中氮元素的质量分数是%;(计算结果均保留两位小数)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。
回答下列问题 :
(1)仪器名称A _B
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D(具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后 ,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为 。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液 。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:
|

氧化还原滴定法是科研和生产中测定溶液中物质浓度的常用方法。
⑴莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度 [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②硝酸银标准液应装在 式滴定管中滴定。
③已知该滴定适宜的酸度范围是pH 6.5~10.5,但当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl-及时释放出来,防止滴定终点提前
⑵氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
 实验数据 实验数据实验序号 |
FeSO4溶液体积读数/mL |
|
| 滴定前 |
滴定后 |
|
| 第一次 |
0.10 |
16.20 |
| 第二次 |
0.30 |
15.31 |
| 第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72-+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)