“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。

回答下列问题 :
(1)仪器名称A _B
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D (具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后 ,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为 。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液 。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:
|

现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是。除了图中给出的的仪器和托盘天平外,
为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为。(装置II)
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ______。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不损失点滴液体,否则会使溶液的浓度偏(高或低) |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签。 |
E.改用加水,使溶液。若加水超过刻度线,会造成溶液浓度应该。
F.继续往容量瓶内小心加水,直到液面接近刻度处
某学生应用如图所示的方法研究物质的性质,其中气体 A 的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
⑴该项研究(实验)的主要目的是_____________________________
⑵浓H2SO4的作用是____________,与研究目的直接相关的实验现象是_____________
⑶从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现__________________
请在图中的D处以图的形式表明消除该事故隐患的措施。
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是。
实验中发生反应的化学方程式是。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:







 ①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是。
A.等待实验装置冷却 |
B.上下移动量筒f,使其中液面与广口瓶中液面相平 |
C.上下移动量筒g,使其中液面与广口瓶中液面相平 |
D.视线与凹液面的最低点水平读取量筒中水的体积 |
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
 ①装置中导管a的作用是。
①装置中导管a的作用是。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



假如你是一位企业家,在众多开发海水资源的项目中,选择了海水提镁,在前期考察过程中你将遇到许多问题,请根据背景材料的提示,按要求完成相关问题:
背景材料1:下面所示为海水中各元素含量情况(mg/L)
| 元素 |
浓度(mg/L) |
元素 |
浓度(mg/L) |
| 钠 |
10 770 |
氯 |
19 350 |
| 镁 |
1 290 |
硫 |
885 |
| 钾 |
380 |
溴 |
67 |
| 钙 |
400 |
碘 |
0.06 |
背景材料2:部分化学试剂的市场价格
| 试剂 |
氢氧化钾 |
氢氧化钠 |
氢氧化钙 |
氧化钙 |
| 价格(元/吨) |
5 238.00 |
2 300.00 |
1 200.00 |
700.00 |
请完成下列问题:
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案:
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案________最合理。
不选方案________的理由是________________________________________________
不选方案________的理由是_______________________________________________
(2)应该选择________试剂作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格比为________。
(3)为了节省成本,考虑以海边上的贝壳为原料,试简述其理由__________________________
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如图所示的工艺流程生产单质碘: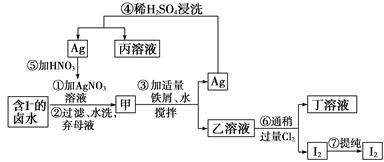
试回答:
(1)乙、丁中溶质的化学式:乙__________,丁__________。
(2)第④步操作中用稀硫酸浸洗的目的是________(填字母编号)。
| A.除去未反应的NO3— | B.除去未反应的I- |
| C.除去未反应的Fe | D.除去碱性物质 |
(3)第⑦步操作可供提纯I2的两种方法是____________和_________(不要求写具体步骤)。
(4)实验室检验I2的方法是_______________________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)__________________________