(15分)某兴趣小组利用下列实验装置进行探究实验。
根据要求回答下列问题:
(1)装置中长颈漏斗的作用有导气、 。
(2)利用装置C可以证明S02具有漂白性,C中盛放的溶液是 ;若要证明其
漂白作用是可逆的,还需要的操作是 。
(3)通过观察D中现象,即可证明S02具有氧化,D中盛放的溶液可以是 。
a.NaCl溶液 b.酸性KMn04 c.FeCl3 d.Na2S溶液
(4)研究小组发现B中有白色沉淀生成,若往B中加入过量稀盐酸,沉淀不溶解。沉淀物的化学式是 。
(5)为进一步验证B中产生沉淀的原因,研究小组进行如下两次实验:
实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊。
实验ii:用下图F装置代替上述实验中的A装置(其他装置不变),连接后往装置F中通入气体X一段时间,再加入70%H2S04溶液,结果B中没有出现浑浊。
①“实验i”中煮沸BaCl2溶液的目的是 ;
②气体X不可以是 (填序号)。
a.C02 b.03 c.N2 d.N02
③B中形成沉淀的原因是(用化学方程式表示): 。
由于Fe(OH)2极易被氧化;所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)a电极材料为________,其电极反应式为_______________.
(2)电解液d可以是________,则白色沉淀在电极上生成;也可以是________,则白色沉淀在两极之间的溶液中生成。(填字母代号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是:;在加入苯之前,对d溶液进行加热煮沸处理的目的是:.
(4)为了在短时间内看到白色沉淀,可以采取的措施是。
A.改用稀硫酸做电解液
B.适当增大电源电压
C.适当缩小两电极间距离
D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为:.
写出反接后两极的电极反应式:
阳极:
阴极:
实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨摇动
其正确的操作顺序为____________________(填序号)。本实验必须用到的仪器有托盘
天平、药匙、玻璃棒、烧杯、_______、。
(2)某同学欲称量NaOH的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状
态如图所示。烧杯的实际质量为________g,要完成本实验该同学应称量________g NaOH。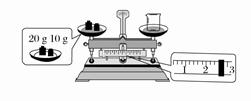
(3)使用容量瓶前必须进行的一步操作是 。
(4)配制过程中,下列操作会引起所配溶液浓度偏高的是
| A.转移溶液时,有少量溶液洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却至室温就将溶液移入容量瓶中并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线 |
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。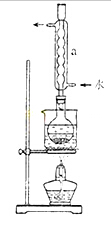
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是。
(2)仪器a的名称是。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是,检验是否存在该杂质的方法是。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示产品发黄的原因。
II.测定产品纯度准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化:。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。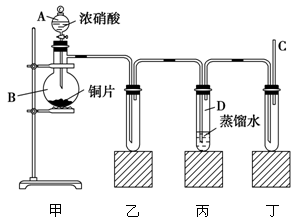
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式为________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________________;________________;装置丙中的试管内发生反应的离子方程式为________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
试回答:
(1)操作I为(填写操作名称)。
(2)操作III的顺序依次为:、冷却结晶、过滤、 、干燥。
(3)试剂Y(一种单质)与溶液X反应的离子方程式为。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是(夹持部分略去)(填字母序号)
③滴定时发生反应的离子方程为:
④若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为