下列物质互为同分异构体的是( )
A.1H、D、T B.C60和C70
C.正戊烷和新戊烷 D.CH3OC2H5和CH3CH2OCH3
对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
| A.增大压强 | B.升高温度 |
| C.使用催化剂 | D.多充O2 |
如图为1 mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )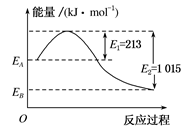
| A.甲烷燃烧为吸热反应 |
| B.甲烷的燃烧热ΔH=-802 kJ·mol-1 |
| C.EA-EB=1 015 kJ |
| D.该反应的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1 |
某实验小组学生按照课本实验要求,用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量计算中和热。下列说法正确的是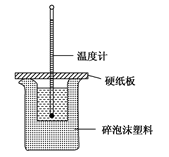
| A.实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D.酸或碱的物质的量越大,所测中和热的数值越大 |
下列热化学方程式书写正确的是( )
| A.C+H2O===CO+H2ΔH=+131.3 kJ·mol-1 |
B.H2(g)+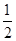 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ |
| D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1 |
化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )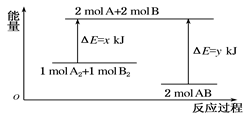
该反应是吸热反应
断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C.断裂2 mol A—B键时需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量