已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。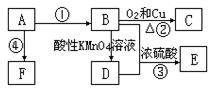
(1)A的最简式为:____________,C的名称:_____________,F的结构简式:____________________________________
(2)D分子中的官能团名称是_________________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________
(3)写出下列反应的化学方程式并指出反应类型:③____________________________,反应类型_____________。
新合成的一种烃,其碳架呈正三棱柱(如图所示)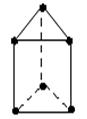
(1)写出该烃的分子式_____________________________。
(2)该烃的一氯代物是否有同分异构体?_______。(填“是”或“否”)
(3)该烃的二氯取代物有_________________种。
(4)该烃的同分异构体有多种,其中一种不能使酸性高锰酸钾溶液或Br2的CCl4溶液褪色,但在一定条件下能跟溴发生取代反应,和H2能发生加成反应,这种同分异构体的结构简式是_______________________________。
某高分子材料的结构为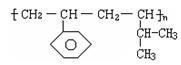 ,则其对应的单体的结构简式为:______________________,______________________。
,则其对应的单体的结构简式为:______________________,______________________。
组成一种原电池如图所示。试回答下列问题(灯泡功率合适):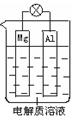
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填
“不亮”做②题)。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
(6分)某种解热镇痛药的结构简式如图所示: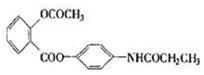
当它完全水解时可得到的产物有种;写出其中含有苯环的产物的结构简式: