苯丙酸诺龙是一种兴奋剂,结构简式为

(I)由苯丙酸诺龙的结构推测,它能(填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性
c.与银氨溶液发生银镜反应 d.与溶液作用生成
苯丙酸诺龙的一种同分异构体,在一定条件下可发生下列反应:

据以上信息回答(2)~(4)题:
(2)的反应类型是。
(3)的结构简式为。
(4)的化学方程式是。
有三种物质AC2、B2C2、AD4,第二周期元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)A、B、C的元素名称分别为、、。
(2)AD4分子其中含有的σ键类型为(选填“s-sσ键”、“s-p  σ键”或“p-pσ键”)。键角为, AD4的等电子体有。
σ键”或“p-pσ键”)。键角为, AD4的等电子体有。
(3)D的负一价阴离子的电子排布式为,B2C2的电子式为,属 (填“离子化合物”或“共价化合物”)。1mol B2C2与足量AC2反应转移的电子个数为 。
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中: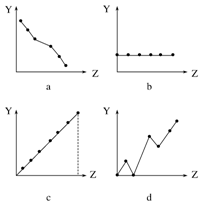
①ⅡA族元素的价电子数。
②第三周期元素的最高化合价。
③F-、Na+、Mg2+、Al3+的离子半径。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为。
②X、Y、Z元素符号分别为:X、Y、Z。
③工业上制取单质M的化学方程式为_____________________________ 。
短周期元素A、B、C、D,其离子半径逐渐增大,它们的原子中核外都有一个未成对电子。已知A和D处于同一周期,0.2摩尔A单质可以从D的氢化物的水溶液中置换出6.72 L氢气(标准状况),试回答:
(1) A、B、C、D元素分别是A:,B:,C:,D:。
(2)比较C和D的氢化物(用分子式表示):
稳定性>,水溶液的酸性>
(3)用电子式表示化合物BD的形成过程
按要求完成下列各小题
(1) 写出Cu的电子排布式
(2) 画出Ca的原子结构示意图
(3) 写出Se的简化电子排布式
(4) 写出Mn的价电子排布式
(5) 画出N原子的电子排布图
(6)Zn位于周期表第周期 族 区。
(8分)用元素符号填空(放射性元素除外):
(1)原子半径最小的元素是,原子半径最大的元素是。
(2)第一电离能最小的元素是,第一电离能最大的元素是。
(3)电负性最小的元素是,电负性最大的元素是。
(4)金属性最强的元素是,非金属性最强的元素是。