实验室常利用甲醛法测定样品中氮的质量分数,其反应原理为: [滴定时,1 与 l 相当],然后用标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500。
步骤II 将样品溶解后,完全转移到250 容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00样品溶液于250锥形瓶中,加入1020%的中性甲醛溶液,摇匀、静置5 后,加入1~2滴酚酞试液,用标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:①碱式滴定管用蒸馏水洗涤后,直接加入标准溶液进行滴定,则测得样品中氮的质量分数(填"偏高"、"偏低"或"无影响")。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去标准溶液的体积(填 "偏大"、"偏小"或"无影响")
③滴定时边滴边摇动锥形瓶,眼睛应观察[]
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色。
(2)滴定结果如下表所示:

若标准溶液的浓度为0.1010则该样品中氮的质量分数为
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+□=□Fe(OH)3↓+□C1-+□
②检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 :
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比
为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,
⑥氯水和KSCN的混合溶液
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________、____________、
_____________。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______物质_____mol。
已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。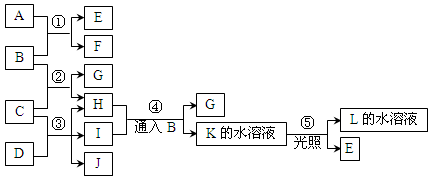
(1)F的俗名是,B分子的结构式为________工业上利用反应③生产。
(2)反应④的离子方程式为。
(3)有一种单质能与H反应生成E,该反应的化学方程式为。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反应的离子方程式为。
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl-。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+_____MnCl2+_____Cl2↑+____H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为____,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |
将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目: