根据物质的性质和组成特点,可将NaOH(固)、P2O5和CaCl2(固)归为一类。从以下选项中选出能与这三种物质归为一类的物质应该是( )(单选)
| A.浓H2SO4 | B.NaCl | C.碱石灰 | D.CaO |
在298K、100kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2 (g)=2HCl(g) ΔH2
2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
将等质量的两份锌粉a、b分别加入过量的稀硫酸。同时向a中加入少量CuSO4溶液。图中产生H2的体积V L与时间t min的关系正确的是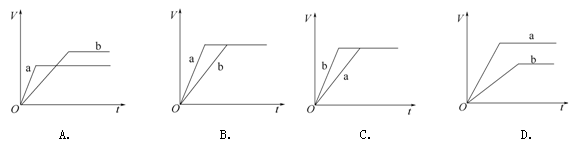
0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
| A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—) | B.c(H+)= c(OH—) |
| C.c(K+)=c(S2—)+c(HS—)+c(H2S) | D.c(OH-)=c(H+)+c(HS—)+2c(H2S) |
下列溶液一定是碱性的是
| A.pH=8的某电解质的溶液 | B.c(OH-)>1×10-7mol/L |
| C.溶液中含有OH- | D.溶液中c(OH-)>c(H+) |