按要求回答下列问题
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是 
①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
(2)若向等量的两份稀硫酸a和b中, 分别加入过量的锌粉, 并向a中加入少量铜粉, 下图表示产生H2的体积(V)与时间(t)的关系正确的是 ,若向a中加入少量CH3COONa固体,图像正确的是 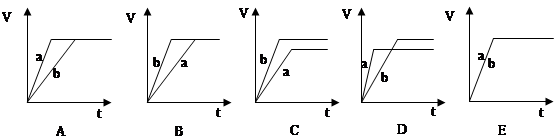
相同物质的量浓度的NaCN和NaClO溶液相比,NaCN溶液的pH较大,则关于同温同体积同浓度的HCN和HClO的说法中正确的是
| A.电离程度:HCN>HClO |
| B.pH:HClO>HCN |
| C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D.酸根离子浓度:c(CN-)<c(ClO-) |
某酸式盐NaHY的水溶液中存在c(OH-)>c(H+),则下列叙述正确的是
A.H2Y的电离方程式:H2Y 2H++Y2- 2H++Y2- |
B.HY—的水解方程式:HY—+H2O H3O++Y2- H3O++Y2- |
| C.该酸式盐溶液中粒子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+) |
| D.该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-) |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
下列各溶液中,有关离子的物质的量浓度关系正确的是
| A.已知H2C2O4为二元弱酸,则Na2C2O4溶液:c(OH-)= c(H+)+ c(HC2O4-)+c(H2C2O4) |
| B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-) |
| C.饱和食盐水中:c(Na+)+c(OH-)=c(Cl-)+c(H+) |
| D.50℃时,pH=12的NaOH溶液中:c(OH-) =1.0×10-2 mol·L-1 |
已知下列三个数据:7.1×10-4 mol·L-1、6.8×10-4 mol·L-1、6.2×10-10 mol·L-1分别是三种酸的电离平衡常数。若这三种酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③ NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是
| A.HF的电离平衡常数为7.1×10-4 mol·L-1 |
| B.HNO2的电离平衡常数为6.2×10-10 mol·L-1 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN的大,比HF的小 |