实验:①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
②取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀; ④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中不正确的是
| A.将①中所得浊液过滤,所得滤液中含很少量Mg2+ |
B.①中浊液中存在溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
| C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 |
D.NH4Cl溶液中的NH 可能是④中沉淀溶解的原因 可能是④中沉淀溶解的原因 |
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
2C(s)+O2(g)=2CO(g)△H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH= bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
C.Cl-Cl键的键能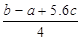 kJ·mol-1 kJ·mol-1 |
D.P-P键的键能为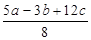 kJ·mol-1 kJ·mol-1 |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:
CuSO4·5H2O(s)△CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
| A.△H2>△H3 | B.△H1<△H3 |
| C.△H1+△H3 =△H2 | D.△H1+△H2>△H3 |
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+  O2(g)=SO2(g)+H2O(g)△H1
O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=  S2(g)+2H2O(g)△H2
S2(g)+2H2O(g)△H2
③H2S(g)+ 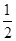 O2(g)=S(g)+H2O(g)△H3
O2(g)=S(g)+H2O(g)△H3
④2S(g) =S2(g)△H4
则△H4的正确表达式为
| A.△H4=2/3(△H1+△H2-3△H3) |
| B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=3/2(△H1+△H2-3△H3) |
| D.△H4=3/2(△H1-△H2-3△H3) |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2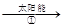 (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2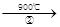 mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO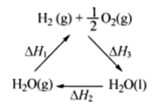
下列说法不正确的是
| A.该过程中CeO2没有消耗 |
| B.该过程实现了太阳能向化学能的转化 |
| C.上图中△H1=△H2+△H3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O |