某溶液中含有较多的Na2SO4和少量的 Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4·10H2O),可供选择的操作有:
①加适量H2SO4溶液;②加金属钠;③结晶;④加过量NaOH;⑤加强热脱结晶水;⑥过滤。正确的操作步骤是
| A.②⑥③ | B.④⑥①③ | C.④⑥③⑤ | D.②⑥①③⑤ |
Ⅰ.下列实验操作中,叙述正确的是 (填字母)
| A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏小 |
| B.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 |
| C.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯 |
| D.做焰色反应的铂丝,用硫酸洗涤后,再在酒精灯火焰上灼烧至无色,才可使用 |
E.向溶液中加盐酸酸化的BaCl2 ,如果产生白色沉淀,则一定有SO
F.证明某盐中含有NH4+的方法是:取该盐加入强碱溶液加热,如果产生使湿润的蓝色石蕊试纸变红的气体,便证明有NH4+
G.使用容量瓶配置一定浓度的溶液时,俯视刻度线定容后所得溶液的浓度偏高
H.用灼烧法鉴别棉织品和毛织品,有焦臭味的是毛织品
Ⅱ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
利用工厂的废铁屑(含少量Fe2O3、SiO2、锡等),制备绿矾(FeSO4·7H2O)的过程如下:
已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
②溶液X加KSCN不显红色。
(1)操作I的名称为 ,所需玻璃仪器为_______________。
(2)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(3)操作 II 中,试剂 Y 是_______,然后用稀硫酸将溶液酸化至 pH="2" 的目的是 。
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式 。
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。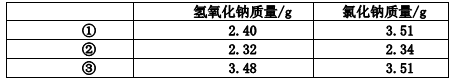
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是______________________.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是________.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A KI溶液 B淀粉溶液 C NaOH溶液 D稀H2SO4 E氯水
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
(3)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如右图所示的实验装置,验证该产物的存在。实验步骤及现象如下:制 H2、验纯,将火焰对着冰块。
①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小烧杯放在冰块下方,观察到烧杯中溶液由无色变成了蓝色。
②在另一个小烧杯内加入用硫酸酸化的稀 KMn04溶液,将小烧杯放在冰块下方,观察到烧杯中溶液变成了无色。请你写出另一产物的结构式: ;
由上述实验中可以归纳出该产物的化学性质有 。
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤.
①写出左边集气瓶的作用 。
②石灰乳的作用是: (用化学方程式表示)
③写出MnO2和H2SO3反应的离子反应方程式 。
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 (选择选项填空)。
a.缓慢通入混合气体 b.快速通入混合气体c.控制适当的温度 d.高温加热
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
① 边搅拌边加入Na2CO3,并控制溶液pH<7.7;
② ;
③ 检验SO42-是否被洗涤干净。检验水洗是否合格的方法是 。
④ 用少量C2H5OH洗涤,其目的是 ;
⑤ 低于100℃干燥。
某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备。供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰。
仪器装置:
已知四氯化锡具有强的吸水性,水解生成锡的氧化物。
SnCl4和Sn的部分数据如下:
| 密度/(g·cm-3) |
熔点/℃ |
沸点/℃ |
|
| 四氯化锡 |
2.2 |
-33 |
114 |
| 金属锡 |
5.77 |
231 |
 |
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A  ____
____ _____
_____ _____
_____ _____
_____

(2)仪器G的名称是_______实验时,冷却水的流向是从_________进入(填符号)
(3)A中反应的离子方程式 ;
(4)F中盛装的化学试剂是_________;作用是 、 。写出SnCl4水解的化学方程式
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是