在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是______(填正确选项的标号)
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂也不是还原剂 |
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为______________(填“对”或“不对”),其理由是___________________________________________.
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是_______>________>______.
PET是世界上产量最大的合成纤维。其结构简式为: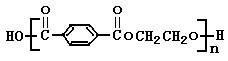
有人以石油产品对二甲苯和最简单的烯烃D为原料,设计合成PET的工业生产流程如下图所示(反应中部分无机反应物及产物未列出)。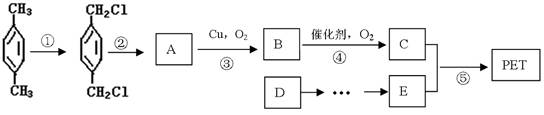
请回答下列问题:
(1)发生反应①时,需加入的反应物及反应条件是、。发生反应②时,需加入的反应物及反应条件是、。
(2)有机物A有多种同分异构体,写出满足下列条件的A的一种同分异构体X的结构简式。
①在X中滴入FeCl3溶液,溶液呈紫色;②X的分子结构中只有一个甲基;③1molX分别与足量的金属钠、NaOH溶液反应,消耗n(Na):n(NaOH)=2:1。
(3)写出反应⑤的化学方程式,其反应类型是。
(4)从D到E,工业上一般通过二步反应来完成。有人从原子利用率100%的角度提出通过D与某无机物一步合成E,该无机物的化学式是。
A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A具有如下性质:①可以使溴水褪色。②难溶于水。③在酸性条件下1molA发生水解反应,得到1molB和2mol甲醇。
(1)A可以发生的反应有(选填编号)
①加成反应②酯化反应③加聚反应④氧化反应
(2)B分子所含官能团的名称是、。
(3)与B具有相同官能团的同分异构体的结构简式是 ____。
(4)由B制取A的化学方程式是:。
(1)按系统命名法命名有机物:CH3CH(C2H5)CH(CH3)2的名称是________。
(2)写出下列有机物的结构简式①2,3-二甲基-4-乙基已烷 ____________。
②支链只有一个乙基且相对分子质量最小的烷烃。
(3)下列各化合物中,属于同系物的是(填入编号),属于同分异构体的是。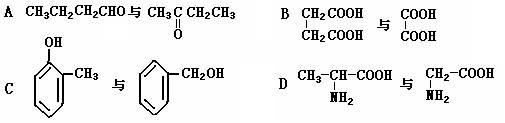
(4)某有机物的分子式是C2H6O2,它的红外吸收光谱表明有羟基O—H键和烃基上C—H键的红外吸收峰,其核磁共振氢普如图所示。该有机物的结构简式是。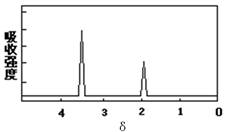
A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是常温常压下能使湿润红色石蕊试纸变蓝色的气体;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图,G的化学式是。
(2)比较BC和EC2的碱性强弱BCEC2(填<、>、="" )。
(3)F与C反应生成D的离子方程式。
(10分)已知乙烯能发生以下转化: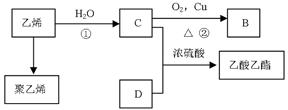
(1)乙烯的结构式为:_________________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称___________;D中含官能团名称____________。
(3)写出反应的化学方程:
①______________________________________________;反应类型:________。
②______________________________________________。