有一块Fe、Al合金,将其全部溶于盐酸中,并通人足量的Cl2,再加入过量的NaOH溶液,过滤,将沉淀充分灼烧,得到的固体粉末跟原合金质量相等,求合金中铝的质量分数。
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过 程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是。
程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)
。
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成和;不仅可以形成,还可以形成碳环。
(3)上图中互为同分异构体的是:A与;B与;D与。(填编号)
将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 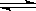 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为:;
(2)反应前A的物质的量浓度是:;
(3)10s末,生成物D的浓度为;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
“不变”填空)。
| 编号 |
改变的条件 |
生成D的速率 |
| ① |
降低温度 |
|
| ② |
增大A的浓度 |
|
| ③ |
使用催化剂 |
|
| ④ |
恒容下冲入Ne(不参与体系反应) |
A、B、C和D等4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B在周期表中的位置第周期,第族;
(2)A、B形成的化合物的电子式;
(3)C的元素名称________,C的最高价氧化物的 化学式;
化学式;
(4) D的最高价氧化物对应的水化物的化学式。
某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某兴趣小组同学利用以下装置测定铁的氧化物的组成,请回答下列问题:
(已知 )
)
(1)装置甲的作用是。
(2)装置丁中的实验现象是。
(3)若丙中铁 的氧化物的化学式为FexOy,则丙中反应的化学方程式为。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x : y=,该固体粉末的组成为。
的氧化物的化学式为FexOy,则丙中反应的化学方程式为。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x : y=,该固体粉末的组成为。