下列反应的离子方程式正确的是……( )
| A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B.等体积等物质的量浓度的氢氧化钡溶液与硫酸溶液混合 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.向次氯酸钙溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D.过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O |
当前我国环保亟待解决的“白色污染”,通常是指( )
| A.金属冶炼厂排放的白色烟尘 | B.白色建筑废料 |
| C.烧制石灰时的白色粉尘 | D.聚乙烯等塑料垃圾 |
烷烃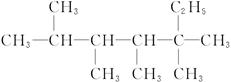 是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有()
是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有()
| A.4种 | B.5种 | C.6种 | D.7种 |
由A和B两种烃组成的混合物,当混合物质量一定时,无论A和B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。A和B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的实验式;④烃中碳的质量分数相同。正确的结论是()
| A.①②③④ | B.①③④ |
| C.②③④ | D.③④ |
乙烯和丙烯按1∶1(物质的量)聚合时,生成聚合物乙丙树脂,该聚合物的结构简式可能是()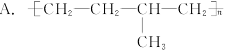
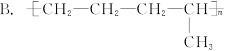
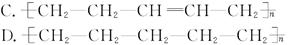
对比甲烷和乙烯的燃烧反应,下列叙述中正确的是()
| A.二者燃烧时现象完全相同 | B.点燃前都应验纯 |
| C.二者燃烧的火焰均呈淡蓝色 | D.二者燃烧时都有黑烟生成 |