中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)
A.cB=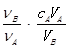 |
B.cB=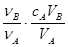 |
C.cB= |
D.cB=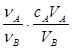 |
用惰性电极进行电解,下列说法正确的是:
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH—,故溶液pH减小 |
C.电解硫酸钠溶液,在阴极上和 阳极上析出产物的物质的量之比为1:2 阳极上析出产物的物质的量之比为1:2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
恒温、恒压下,将1molO2和2molSO2气体充入一个体积可变的容器中(状态Ⅰ),发生反应:2SO2+O2 2SO3,状态Ⅱ时达平衡,则O2得转化率为:
2SO3,状态Ⅱ时达平衡,则O2得转化率为: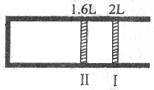
| A.40% | B.60% | C.80% | D.90% |
某体积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下发生反应:N2(g)+3 H2(g)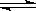 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。
| A.原混合气体的体积为1.2V L | B.原混合气体的体积为1.1VL |
| C.反应达平衡时N2消耗掉0.05 V L | D.反应达平衡时H2消耗掉0.5 V L |
下列因素中,对反应Fe3+(aq)+3SCN—(aq) Fe(SCN)3(aq)的速率不产生显著影响的是
Fe(SCN)3(aq)的速率不产生显著影响的是
| A.浓度 | B.温度 | C.压强 | D.反应物的性质 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
A.由Al、Cu 、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ 、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |