实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5 mol·L-1,下面四个选项中能达到此目的的是( )
A.Fe2+、Na+、NO 、Cl- 、Cl- |
B.Mg2+、NH 、SO 、SO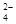 、NO 、NO |
| C.H+、K+、Cl-、CH3COO- | D.K+、Mg2+、CO 、OH- 、OH- |
下列图示中正确的实验操作是( )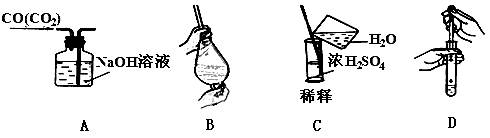
| A.除去CO中的CO2 | B.萃取时振荡 |
| C.稀释浓硫酸 | D.向试管中滴加液体 |
研究表明:多种海产品体内含有+5价的砷(As)元素,对人体无毒,而砒霜的成分是As2O3,有剧毒;青菜中含有维生素C.专家忠告:不要同时大量食用海鲜和青菜,否则容易中毒。下面有关解释不正确的是()
A.As2O3中As元素为+3价
B.致人中毒过程中砷元素发生氧化反应
C.维生素C能将+5价砷还原成As2O3
D.维生素C具有还原性
下列说法正确的是()
| A.图a中,随着电解的进行,溶液中c(H+)增大 |
| B.图b中,Mg电极做电池负极 |
| C.图c中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D.图d中,K分别与M、N连接,Fe电极均受到保护 |
一定条件下,碳钢腐蚀与溶液pH的关系如下表。下列说法不正确的是()
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
A.当溶液pH<4,碳钢主要发生析氢腐蚀
B.当溶液pH>13.5,碳钢腐蚀的正极反应式为O2+4H++4e-=2H2O
C.当溶液pH>6,碳钢主要发生吸氧腐蚀
D.煮沸除去氧气的碱性溶液中,碳钢腐蚀速率会减缓
化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是()
| A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 |
| B.由C(石墨)==C(金刚石)-1.9KJ可知,金刚石比石墨稳定 |
| C.根据热化学方程式:S(s)+O2(g)=SO2(g)+297.23kJ,可推知1molSO2(g)的能量总和大于1moS(s)和1molO2(g)的能量总和 |
| D.在稀水溶液中 H+(aq)+OH-(aq) ="=" H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |