溶液中有0.2mol XO ,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
为( )
| A.+4 | B.+3 | C.+1 | D.0 |
下列微粒半径大小比较正确的是()
A.Na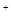 <Mg <Mg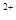 <Al <Al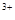 <O <O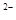 |
B.S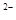 > Cl > Cl >Na >Na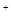 >Al >Al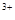 |
| C.Na<Mg<Al<S | D.Cs<Rb<K<Na |
在加入铝粉能放出H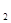 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )
A.Na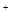 、Fe 、Fe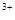 、SO 、SO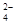 、Cl 、Cl |
B.Ba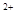 、Mg 、Mg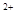 、HCO 、HCO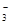 、NO 、NO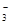 |
C.Na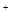 、K 、K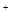 、NO 、NO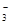 、CO 、CO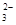 |
D.K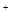 、NO 、NO 、AlO 、AlO 、OH 、OH |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知()
| W |
X |
|
| Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
用下图所示装置进行实验,下列对实验现象的解释不合理的是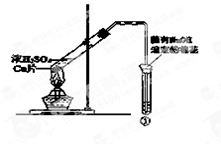
| ①中试剂 |
①中现象 |
解释 |
|
| A |
Ba(NO3)2溶液 |
生成白色沉淀 |
SO32-与Ba2+生成白色BaSO3沉淀 |
| B |
品红溶液 |
溶液褪色 |
SO2具有漂白性 |
| C |
紫色石蕊溶液 |
溶液变红 |
SO2与水反应生成酸 |
| D |
酸性KMnO4溶液 |
紫色褪去 |
SO2具有还原性 |
下列反应的离子方程式正确的是
| A.NaHCO3溶液与盐酸:CO32− + 2 H+ = H2O + CO2↑ |
| B.硝酸银溶液与铜:Cu + Ag+ = Cu2++ Ag |
| C.金属钾与水反应: K +H2O=K+ +OH-+ H2↑ |
| D.用醋酸除水垢:2CH3COOH + CaCO3 = Ca2+ + 2CH3COO− + H2O + CO2↑ |