
稀薄燃烧是指汽油在较大空气/燃比(空气与燃油气的体积比)条件
下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的
重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为
N2。不同空/燃比时汽车尾气中主要污染物的含量变化如图所示。
(1)稀薄燃烧技术除能节约能源外,还具有的优点是 (填一项)。排放到大气中的NOx会导致酸雨、 等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。







若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,
需要测量并记录的数据是 。
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是 (填字母),原因是 。
A.① B.② C.都有可能
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中A1N的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案l】取一定量的样品,用以下装置测定样品中AIN的纯度(夹持装置已略去)。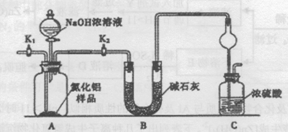
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度: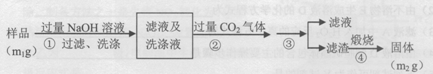
(4)步骤②生成沉淀的离子方程式为 。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: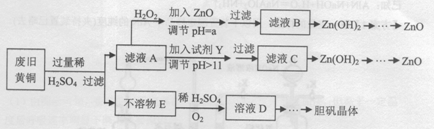
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。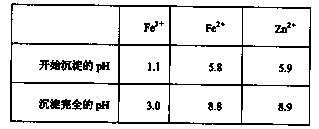
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 ,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为 。
(3)滤液A中加入H202反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是 。
| A.ZnO | B.NaOH | C.Na2CO3 | D.ZnSO4 |
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 。
欲测定镁铝合金中金属铝的百分含量
Ⅰ:甲同学利用下图所给的仪器组成一套实验装置(仪器不一定全选,已知:室温时的气体摩尔体积为24.0 L/mol)。
填写下列各项(气流从左到右):
(1)装置中导管W的作用是 。
(2)各种仪器的连接顺序(填接口字母)是。
(3)连接好仪器后,要进行以下操作,其先后顺序是(填序号)。
①待装置中的温度恢复至室温;
②擦掉镁铝合金条表面的氧化膜,将其置于电子天平上称量质量为0.39 g,并将其投入锥形瓶中;
③检查装置的气密性;
④旋开装置A中分液漏斗的活塞,使其中的稀盐酸顺利流下,当合金条完全溶解时再关闭活塞,此时A中共加入稀盐酸10 mL;
⑤测得量筒中水的体积为480 mL。
(4)根据实验数据计算合金中铝的质量百分数(保留小数点后一位数字)。
(5)读数时除上述①注意事项外,还应有 (写出一点即可)。
Ⅱ:乙同学的方案:称量0.39 g 镁铝合金条,放在如图所示装置的惰性电热板上,通电使其灼烧。欲计算铝的百分含量,该实验还需要测定的数据是。丙同学提出该实验可能会存在较大误差,其理由是。
Ⅲ:丁同学另称量3.9 g的同样的镁铝合金条,投入VmL 1mol/L的NaOH溶液中,充分反应后,过滤、洗涤、干燥、称量固体质量,再计算铝的含量,与甲同学的测量结果相同。写出发生反应的离子方程式,计算NaOH溶液的体积V≥ mL。
(14分)环己酮是重要化工原料,可用于制造尼龙、己二酸等产品。可以尝试用次氯酸钠氧化环己醇制环己酮: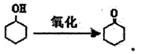
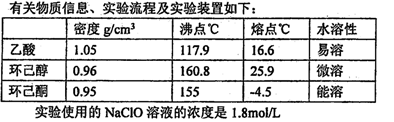
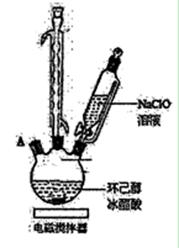
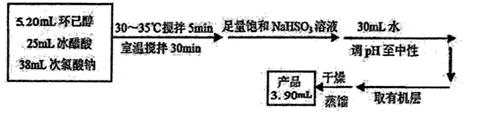
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为。
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35 ℃,除了用冰水浴冷却外,采取的措施还可能有____,并应在三颈瓶的A端口处应补加(仪器名称)。
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为。
(4)为将溶液的pH调至中性,可以加入的试剂是。
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率。
(15分)本题由I,II两部分组成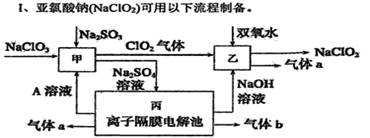
(1)A的化学式是,甲中发生反应的化学方程式为。
(2)乙中反应的离子方程式是。
(3)装置丙产生气体b的电极反应式为。
II、某溶液仅含下列离子中的几种,且所含各种离子的物质的量浓度均为0.lmol/L(忽略水的电离及离子的水解)。K+Ag+ Mg2+Al3+ NH4+Cl- CO32- NO3-SO42- I-
用如下各步实验分析该溶液组成:
①取5 mL溶液,滴少量稀氨水,发现溶液中有沉淀生成,且离子种类增加。
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,火焰不显紫色。
③另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
④向步骤③实验所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(4)由步骤②判断,溶液中一定不含有的阳离子是____;步骤③中生成无色气体的化学式是__。
(5)最终确定溶液中所含阴离子有__。
(6)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体化学式为____。