某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。


 可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
 已知:氢氧化钠溶液不与
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应








(1)  实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2)  滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3)  装置①中发生反应的化学方程式是
装置①中发生反应的化学方程式是
(4)  装置②的作用是 ,发生反应的化学方程式是
装置②的作用是 ,发生反应的化学方程式是
(5)  该小组得出的结论一局的试验现象是
该小组得出的结论一局的试验现象是
(6)  试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a.  加热该绿色溶液,观察颜色变化
加热该绿色溶液,观察颜色变化
b.  加水稀释绿色溶液,观察颜色变化
加水稀释绿色溶液,观察颜色变化
c.  向该绿色溶液中通入氮气,观察颜色变化
向该绿色溶液中通入氮气,观察颜色变化
d.  向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式 。
。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
(1)实验室常用氯化铵固体跟氢氧化钙粉末混合加热制取氨气,该反应的化 学方程式为;
学方程式为;
(2)实验室制取氨气时应用的发生装置是下图中的(填标号),收集装置是
(填标号),选用该收集装置而不用图中另外两个收集装置的原因是。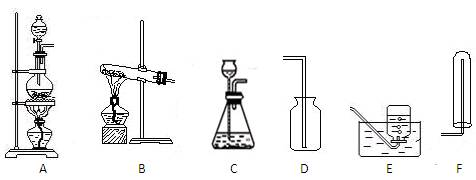
(3)实验室可用C装置制取的气体是(任答一种),该反应的化学方程式为。
为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
; _______________________________
(2)在(1)中应使用除杂试剂的化学式__________,在(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤 ②和④可否颠倒_
②和④可否颠倒_ ___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
步骤③和④可否颠倒___________。
(4)若先用盐酸再进行 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是:
(5)判断BaCl2已过量的方法是
配制一定 物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
(1)、用纸片连称量NaOH固体。 ____________;
(2)、向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。_________;
(3)有少量NaOH溶液残留在烧杯内。____________;
(4)向容量瓶加水时眼睛一直俯视液面。____________。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品22.3g以下图所示装置进行实验。(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是。
(2)此实验还必须用到的最重要的仪器是。
(3)已知仪器C中装有品红溶液,其作用是 。
。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷i.无水氧化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中,D中。
实验过程中,当仪器A的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是。所通空气应先经过氢氧化钠溶液处理,否则可能引起Na2SO3含 量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。
量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为。