为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分: 

请回答以下问题:
(1)混合粉末A中硫粉过量的原因是 ;
(2)反应在“惰气环境”中进行的原因是 ;
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明__________;
(4)操作②的作用是__________。反应方程式是 。也可改用加入__________
(5)操作③稀H2SO4煮沸的目的是 ;
(6)为证明产物中铁的价态,对D溶液的实验操作最好是 。
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
(1)若饱和食盐水中含有酚酞,通电后______(填a或b)侧先变红。
(2)电解反应的化学方程式为___________________________。
(3)漂白粉长期露置在空气中失效,请写出相关氧化还原反应的一条化学方程式____________________。
II.下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右) ;
(2)写出A中反应的离子方程式并用双线桥法表示反应中电子转移的方向和数目_________________;若在标准状态下收集到2.24 L氯气,则被氧化的HCl的物质的量是____________mol。
(3)E管中现象___________________________;脱脂棉的作用是____________________。
右图是硫酸试剂瓶标签上的内容。
(1)该硫酸的物质的量浓度为________________;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
① 需要该硫酸的体积为________mL;
② 有以下仪器: A 烧杯 B 100mL量筒 C 250mL容量瓶
D 500mL容量瓶 E 玻璃棒 F 托盘天平(带砝码)
G 10mL量筒 H 胶头滴管。配制时,必须使用的仪器有______________(填代号); ③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。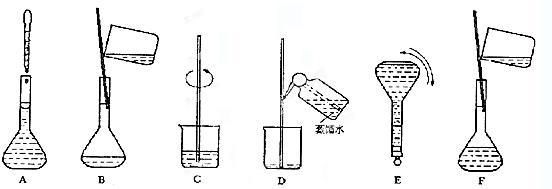
④ 该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_________
| A.量取浓H2SO4时仰视刻度 | B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 | D.定容时仰视刻度 |
KI在食品、医药领域有广泛用途。某科研小组利用碘废弃液(主要含I2、I-)制备KI,流程如下:
已知:I2+2S2O32-=S4O62-+2I-
(1)加入胆矾的作用 。
(2)为制得KI晶体粗产品,滤液后续操作步骤是 。
(3)用沉淀滴定法测定样品中KI含量的实验步骤如下:
a.称取3.000 g样品,溶解,配制成250 mL溶液
b.量取25.00 mL待测液于锥形瓶中;
c.用0.1000 mol•L-1AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液16.50 mL
①配制250mL样品溶液时,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是 。
②AgNO3标准溶液在使用之前通常要重新标定,原因是 ;本实验滴定过程中操作滴定管的图示正确的是___ ____(填编号)。
③该样品中KI的质量百分数为 。
④下列因素会导致KI含量的测定结果偏高的是 。
| A.配制样品溶液定容时仰视 |
| B.锥形瓶未干燥 |
| C.滴定管未用AgNO3标准溶液润洗 |
| D.滴定终点时滴定管尖嘴中产生气泡 |
Ⅰ(1)写出工业上电解饱和食盐水的化学反应方程式
(2)完成以下氧化还原反应的离子方程式
Fe2++ Cr2O72-+ = Fe3++ Cr3++
Ⅱ 水滑石是一类重要的阻燃剂。某研究小组为了探究一种碱式碳酸盐类水滑石M(仅含五种常见短周期元素,带结晶水,其摩尔质量为522 g·mol-1)的组成和性质,设计并完成如下实验:
取52.2g水滑石M进行上述实验,得到4.4g气体乙、15.6g白色沉淀2和23.2g白色沉淀3。
已知:气体甲常温常压下为无色无味液体。回答下列问题:
(1)写出气体乙的结构式 ,白色沉淀2的化学式 。
(2)在惰性气流中加热水滑石M至完全分解的化学方程式为 ,其能够阻燃的原因是_________________________________。
(3)固体1中的某种成分与Cl2、焦炭在一定条件下发生氧化还原反应,生成一种盐(可作净水剂)和常见的气体氧化物,写出一个可能的化学反应方程式 ,并设计实验确定气体产物的成分(假设Cl2已反应完全): 。
实验室配制500 mL 0.1 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入500 mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)计算需要NaCl的质量为__________g,操作步骤的正确顺序为______________(填序号)。
(2)实验中除了用到烧杯、500 mL容量瓶、胶头滴管以外还需要的玻璃实验仪器有_________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?__________(填“偏高”、“偏低”或“无影响”)。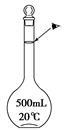
(4)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____________________。