氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:

(1)若饱和食盐水中含有酚酞,通电后______(填a或b)侧先变红。
(2)电解反应的化学方程式为___________________________。
(3)漂白粉长期露置在空气中失效,请写出相关氧化还原反应的一条化学方程式____________________。
II.下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。

(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右) ;
(2)写出A中反应的离子方程式并用双线桥法表示反应中电子转移的方向和数目_________________;若在标准状态下收集到2.24 L氯气,则被氧化的HCl的物质的量是____________mol。
(3)E管中现象___________________________;脱脂棉的作用是____________________。
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下: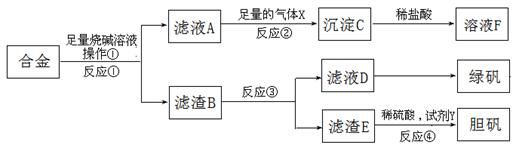
请回答:
(1)操作①用到的玻璃仪器有。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是。
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3__________。
(3) 设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
上述方案是否合理?________ (若不合理,请说明理由;若合理,以下不用回答)
①
②
某同学进行实验研究时,欲配制1.0 mol·L-1 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究其原因,该同学查得Ba(OH)2·8H2O在283 K、293 K和303 K时的溶解度(g/100 g H2O)分别为2.5、3.9和5.6。
(1)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成。设计实验方案,进行成分检验。写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 |
|
| 步骤3:取适量步骤1中的沉淀于试管中,________。 |
|
| 步骤4: |
(2)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250 mL约0.1 mol·L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,_______ _,将溶液转入________中,洗涤,定容,摇匀。
_,将溶液转入________中,洗涤,定容,摇匀。
②滴定:准确量取25.00 mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将______(填“0.020”、“0.05”、“0.1980”或“1.5”)mol·L-1盐酸装入50 mL酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸V mL。
③计算Ba(OH)2·8H2O的质量分数=________(只列出算式,不做运算)。
(3)室温下,_______( 填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。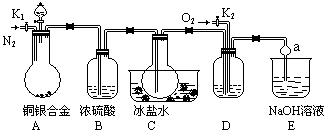
(1)写出A中铜与硝酸反应的一个化学方程式______________________________
(2)反应前先打开A部分的活塞K1,持续通入一段时间的N2,理由是____________
若装置中缺少B部分,会影响验证的结果,其原因是__________________
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是_______________________________
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为_____mol;
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是______________。