某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。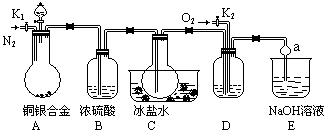
(1)写出A中铜与硝酸反应的一个化学方程式______________________________
(2)反应前先打开A部分的活塞K1,持续通入一段时间的N2,理由是____________
若装置中缺少B部分,会影响验证的结果,其原因是__________________
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是_______________________________
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为_____mol;
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是______________。
下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)。
(2)倒入NaOH溶液的正确操作是(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 3 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
四氯化硅是粗硅精炼中的中间产物,熔点-70℃,沸点57.6℃,在潮湿空气中水解生成硅酸和氯化氢。某兴趣小组在实验室里通过下图所示装置制取少量四氯化硅: 
如何检验上图气体发生装置的气密性: ______________________
A装置中发生反应的离子方程式为: ________________________
A装置中玻璃实验仪器名称为(写出两种即可):_______和_______
B中的液体为:______________F中碱石灰的作用为:① __________②________
先加热图中哪个装置:__________________原因:________________________
若实验中用12mol·L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量
总是小于0.03mol,试分析可能存在的原因是:① __________② _________
(每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
请整理并完成实验报告:
(1)实验目的:。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器:、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
| 实验序号 |
实验现象 |
化学方程式 |
| ① |
有气体产生,溶液变成浅红色 |
|
| ② |
生成浅黄色沉淀 |
Na2S+Cl2=2NaCl+S↓ |
| ③ |
2Na+2H2O=2NaOH+H2↑ |
|
| ④ |
剧烈反应,迅速产生无色气体 |
Mg+2HCl=MgCl2+H2↑ |
| ⑤ |
反应不十分剧烈,产生无色气体 |
2Al+6HCl=2AlCl3+3H2↑ |
| ⑥ |
开始时生成白色胶状沉淀,继而沉淀消失 |
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
(4)实验结论:。
(5)请用原子结构的知识简单解释上述结论:。
(每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题: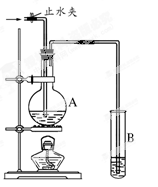
(1)若向A中通入足量的二氧化硫气体,A中的现象是。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是。
(每空2分,共14分)在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于水的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1=s,在答题卷的方框内画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率的结论是。
(3)t1(填“>”或“<”)t4,原因是。t2t3(填“>”或“<”),原因是。