过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2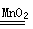 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 |
条件 |
现象 |
结论 |
|
| 温度/℃ |
催化剂 |
|||
| 1 |
40 |
FeCl3溶液 |
|
|
| 2 |
20 |
FeCl3溶液 |
|
|
| 3 |
20 |
MnO2 |
|
|
| 4 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是
实验中可以表明该反应速率差异的现象是
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 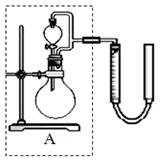
配制并稀释一定质量分数的Na2SO4溶液.
(1)配制50g质量分数为6%的Na2SO4溶液.
①计算:需要Na2SO4 3.0g,水 47.0g
②称量:用托盘天平称量3.0g的Na2SO4.天平调零后,分别在天平左右托盘放上质量相同的纸片,先 ,然后 ,至托盘天平恰好平衡.
③量取:用量筒量取47.0mL水.请在如图中画出47.0mL水的液面位置.
④溶解.
(2)稀释溶液.(由于整个配制过程中溶液很稀,其密度可近似看做1g/mL)
①取1mL 6%的Na2SO4溶液加水稀释至100mL,得到溶液a;
②若用3.0gNa2SO4配制与溶液a浓度相同的溶液,其体积是 mL.
空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
(1)步骤①中发生的是________变化(填“物理”或“化学”)。
(2)写出步骤③中发生反应的化学方程式_________________________________。
(3)上述化学反应中属于化合反应的有________个。
(4)下图是化肥硝酸铵包装袋上的部分说明:硝酸铵应具有的性质是 (填字母)。
A.易溶于水B.有挥发性C.受热易分解
施用该类肥料时,要避免与碱性物质混合使用,写出硝酸铵与熟石灰反应的化学方程式__________________________________。
碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”.实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲.
(1)反应的总化学方程式为:TeOSO4+2SO2+3X Te↓+3H2SO4,则X为 (化学式).
Te↓+3H2SO4,则X为 (化学式).
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
| 实验 |
温度/℃ |
反应时间/h |
粗蹄沉淀率 |
| a |
65 |
3.0 |
65.0 |
| b |
80 |
3.0 |
98.9 |
| c |
80 |
2.0 |
98.9 |
| d |
90 |
2.0 |
97.0 |
①该小组研究的反应条件是 和 .
②实验a和b的目的是 .
③在上述四组实验中,最佳的反应条件是 ℃和 h.
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是 (填选项).
A.80℃,1.5hB.80℃,2.5h
C.70℃,2.0hD.95℃,2.0h.
三瓶遗失标签的无色溶液分别是盐酸、氢氧化钠、氢氧化钙,为鉴别这三瓶溶液进行如下实验。
(1)①气体a的名称是 。
②生成白色沉淀的化学方程式是 。
③如果只用一种试剂来鉴别三种溶液,可选用的试剂是 。
(2)若遗失标签的是氢氧化钙、碳酸氢钠、盐酸三瓶溶液,鉴别时不需外加任何试剂,只需将其中的溶液①分别滴加到另外两种溶液②、③中,若实验现象是:一个有气泡,一个无明显现象,则①是___________。
有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙中的一种或几种。为探究其组成进行如下实验,主要流程及现象记录如下:
【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有的物质是____________。
(2)步骤②中发生反应的化学方程式是____________________________________。
(3)步骤③中产生白色沉淀A的化学方程式是________________________________。
(4)白色固体X中的物质有____________。
(5)将白色固体X转化成氯化钠固体的实验方案是____________________。