配制并稀释一定质量分数的Na2SO4溶液.
(1)配制50g质量分数为6%的Na2SO4溶液.
①计算:需要Na2SO4 3.0g,水 47.0g
②称量:用托盘天平称量3.0g的Na2SO4.天平调零后,分别在天平左右托盘放上质量相同的纸片,先 ,然后 ,至托盘天平恰好平衡.
③量取:用量筒量取47.0mL水.请在如图中画出47.0mL水的液面位置.

④溶解.
(2)稀释溶液.(由于整个配制过程中溶液很稀,其密度可近似看做1g/mL)
①取1mL 6%的Na2SO4溶液加水稀释至100mL,得到溶液a;
②若用3.0gNa2SO4配制与溶液a浓度相同的溶液,其体积是 mL.
实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。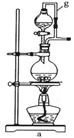

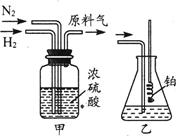
(1)从图中选择制取气体的合适装置:氮气和氢气分别为和。
(2)装置a中g管的作用是;
(3)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
的作用。
(4)氨合成器出来经冷却的气体持续通入乙装置的水中吸收氨,(填“会”或“不会”)发生倒吸,原因是。
(5)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是,锥形瓶中还可观察到的现象是。
(6)写出乙装置中氨氧化的化学方程式:。
下图是用来进行乙醇的氧化和检验氧化产物的实验装置。可供选择的试剂有:铜粉、氧化铜粉末、乙醇、新制氢氧化铜浊液、银氨溶液,所需要其它仪器任选。
1.按照实验步骤,填写表格。
| 序号 |
实验步骤及实验操作 |
| 步骤一 |
检查装置的气密性 |
步骤二 |
装药品:A试管中装入_________;烧瓶C中装入_________;试管D中装入______. |
| 步骤三 |
对A,B,C装置进行加热,先后顺序是____________。 |
| 步骤四 |
当看到现象时停止加热 |
2.如何检查该装置的气密性:__________________________________________。
3.C装置除了装反应药品外,为了防止意外,最好还要加些____________________。
4.反应后A试管中产生的现象是____________,D试管中产生的现象___________。
5.写出A、D试管中的化学反应方程式。
A___________________________ D______________________________。
(8分) .在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ________;Ⅱ________;Ⅲ________;Ⅳ________(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是_______________;
(3)使用装置Ⅱ的目的是_________________;
(4)使用装置Ⅲ的目的是_________________;
(5)确定含有乙烯的现象是_________________。
乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点见下:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙醇 |
水 |
| 沸点/℃ |
20.8 |
117.9 |
290 |
78.2 |
100 |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)
_________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温
度计水银球的位置应在________;当试管A内的主要反应完成后温度计水银球的位置应在_______。
(3)烧杯B内盛装的液体可以是_______。
(4)试管C中收集到的是粗产品,若想进一步提纯,可采用的方法是_____;
提纯后的产品若在质谱仪中进行测定,其质荷比最大是____(填数值);
若在核磁共振仪中进行测定,其核磁共振氢谱共有__种峰,峰面积之比为__。
(每空1分,共7分)溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是。
(2)反应时若温度过高,则有 生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是。
生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的(填写上正确选项的字母)。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
该实验操作中所需的主要玻璃仪器是(填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 ,然后进行的实验操作是(填写正确选项的字母)。
,然后进行的实验操作是(填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后(按实验的操作顺序选填下列序号)。
①加热②加入 溶液③加入稀
溶液③加入稀 酸化④加入NaOH溶液
酸化④加入NaOH溶液