在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。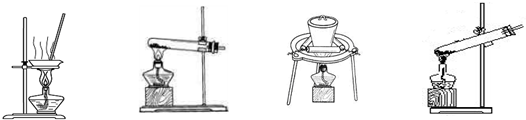
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 |
现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 |
现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象: ; 结论: 。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu (OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 成立。
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是 (填代号)。
A.浓硫酸B.无水CuSO4C.碱石灰D.P2O5
(3)乙同学验证假设3成立的实验现象是 。
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,
其原因是 (填代号)
| 溶解度(S)/g |
溶度积(Ksp) |
摩尔质量(M)/g·mol-1 |
|||
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
100 |
197 |
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2 g,实验结束后装置B的质量增加5.4 g,C中的产生沉淀的质量为39.4 g。则该蓝绿色固体的化学式为 ;A中发生的反应的化学方程式为 。
(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: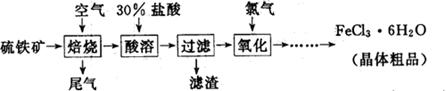
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。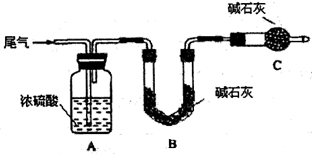
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 。
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下: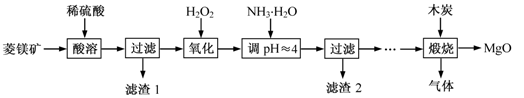
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C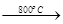 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要 。
A.蒸发皿B.坩埚C.泥三角D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。
正确的连接顺序是a→b→ (按接口连接)。B中盛放的试剂是 ,确定存在二氧化碳气体的实验现象是 。
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题: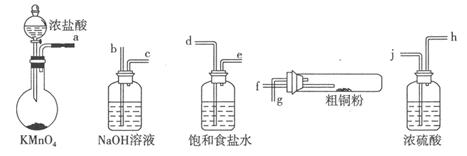
(1)按气流方向连接各仪器接口顺序是:a 、
、  、
、 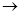 、
、 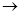 。
。
(2)写出加热时硬质试管中发生化学反应的方程式是 。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是 。
《实验化学》
甲苯氧化法制备苯甲酸的反应原理如下: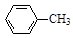 + 2KMnO4
+ 2KMnO4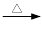
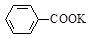 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O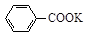 + HCl
+ HCl
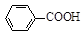 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
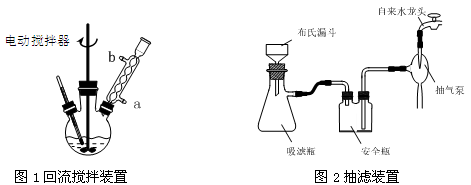
(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。