实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
(2)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,FeS、O2、H2SO4反应的方程式是 ;
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_______________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g。若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数[Mr (BaSO4) =233、Mr (Fe) =56]。(写出计算过程,结果保留4位有效数字)。
有两种盐A和B,A是白色固体,B是黑色固体,它们都跟稀H2SO4反应,其中物质A与稀H2SO4反应生成气体C,物质B与稀H2SO4反应生成气体D。气体C和气体D混合后产生淡黄色固体E。把气体C通入足量的NaOH溶液中生成物质A。物质E跟铁在加热条件下反应生成物质B。试完成下列问题:
(1)用化学式表示:A___________,B___________,C___________, D___________。
(2)完成下列反应的化学方程式:
①物质A和稀H2SO4反应:_____________________________________________________。
②物质B和稀H2SO4反应:_____________________________________________________。
③气体C和气体D反应:_______________________________________________________。
④气体C和NaOH溶液反应:_____________________________________________________。
⑤物质E和铁反应:____________________________________________________________。
有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请完成下列问题:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是__________________________________,被检出的物质的化学式(分子式)是_____________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象是1支试管中有白色沉淀生成,写出相应反应的离子方程式(下同):____________________,2支试管中有蓝色沉淀生成:_______________________,被检出的物质的化学式(分子式)是_____________。
(3)鉴别余下未检出物质的方法和观察到的现象是___________________________________。
设计一个实验只用一种试剂鉴别NaHCO3、NH4Cl、NaCl、NH4HCO3四种无色溶液,简述操作步骤及现象。
如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状下测定)。
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。
漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题: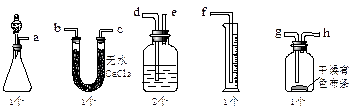
(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U型管可以用( )替代(填装置名称),内盛装的试剂是( )。
(3)洗气瓶中的液体是( )。
(4)在制取氯气前,必须进行的一项操作步骤是( )。
(5)按照实验目的进行之后,干燥有色布条是否褪色( )(填是或否)。
(6)该兴趣小组在实验中,发现量筒中并没有收集到液体,你认为他们失败的原因可能是什么?