有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请完成下列问题:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是__________________________________,被检出的物质的化学式(分子式)是_____________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象是1支试管中有白色沉淀生成,写出相应反应的离子方程式(下同):____________________,2支试管中有蓝色沉淀生成:_______________________,被检出的物质的化学式(分子式)是_____________。
(3)鉴别余下未检出物质的方法和观察到的现象是___________________________________。
某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应式:_______ _____。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:__________________________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_____________。
Ⅱ.利用如图所示装置做电解50 mL 0.5 mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①___ _______;②___________。
(2)分析实验记录B中浅蓝色固体可能是________________(写化学式)
某研究性学习小组模拟工业生产过程进行试验。请回答下列问题:
(1)用如图所示的装置向500—600℃的铁屑中通入氯气制取无水氯化铁的实验中,实验开始前应如何检查装置的气密性 。
(2)用如图装置向炽热铁屑中通入氯化氢制取无水氯化亚铁的实验中,装置A用来制取 。若仍用D的装置进行尾气处理,存在的问题是 、 。
若操作不当,制得的FeCl2会含有少量FeCl3。欲制得纯净的FeCl2,在实验操作中应先 ,再点燃C处的酒精灯。
(3)从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程如下:
①反应①的化学方程式是
②从水浸后的滤液中得到K2SO4晶体的方法是 步骤③的化学方程式是
③焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
甲、乙、丙三位同学分别进行如下实验:
(1)甲同学配制100 mL 0.5mol·L-1的氯化钠溶液。甲同学的基本操作如下,请你帮他把正确的顺序排出来 :(填字母)
(2)乙同学配制100 mL 0.5mol·L-1的稀硫酸。
①若采用18 mol·L-1的浓硫酸配制溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、 、____ 、胶头滴管。
②乙同学的如下操作中,使所配溶液的物质的量浓度偏小的是 :
a.准确量取2.7mL浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀
b.待溶解后立即转移到100 mL容量瓶中
C.用少量的稀硫酸将容量瓶洗涤2~3次
d.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至100mL。
③定容的正确操作是_________________________。
(3)丙同学:室温时,取10 mL乙同学所配硫酸溶液,向其中加水至100 mL,再用PH试纸测其PH的正确操作是_____________ __。若他测得PH为2,你认为可能的原因是 (只写一条)
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其组成,他们进行了以下实验。
Ⅰ.莫尔盐的制取,请回答下列问题。
(1)废铁屑中含氧化铁,无需在制备前除去,理由是________________、_______________(用离子方程式回答),实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有__________(填编号)。
①铁架台 ②玻璃棒 ③广口瓶 ④石棉网 ⑤烧杯 ⑥漏斗 ⑦酒精灯
(2)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是
II.莫尔盐组成的测定
①将摩尔盐低温烘干后,称取7.84 g加热至100℃失去结晶水,质量变为5.68 g。
②选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。
③向A中加入适量3%的H 2 O 2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。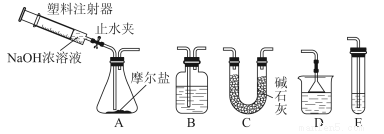
根据上述实验回答下列问题。
(3)步骤②中,选择的装置是A接_________接___________(填代号),A装置中未使用分液漏斗的理由是____________________。
(4)根据上述实验数据计算,摩尔盐中n(NH4+):n(Fe2+):n(SO42-):n(H2O)=_____________
左图是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中可观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。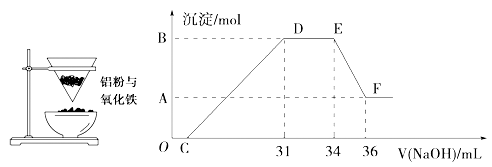
(1)试剂A的名称是 。
(2)探究铝热反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解,(假设固体全部溶解后溶液体积不变),反应过程中无气体放出(活泼金属可把稀 HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量与加入 NaOH溶液 的体积的关系如上右图所示:
①写出DE段发生反应的离子方程式:___________________________
②求c(HNO3)=_____③B与A的差值为_________________
(3)若铝和氧化铁能恰好完全反应。则该铝热剂与盐酸反应时转移电子与所耗H+的物质的量之比